NEUTRALIZACIÓN, PH Y TITULACIÓN
LAURA SOFÍA FLOR TRIANA
DIANA FERNANDA JARAMILLO CÁRDENAS
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
QUÍMICA
IBAGUÉ TOLIMA
10-2
2018
INTRODUCCIÓN
A través del siguiente trabajo podremos identificar que la neutralización es una reacción química que ocurre entre un ácido y una base produciendo una sal y agua; El ph cumple la función de indicar la cantidad de iones de hidrógeno presentes en una solución o sustancia, y por último la titulaciónes un método de análisis químico el cual es usado para determinar la concentración desconocida de un reactivo a partir de un reactivo con concentración conocida. Así mismo se irá interpretando cada una de ellas mediante conceptos, ejemplos y graficos y a través de ellos se podrá observar el desarrollo de una titulación, neutralización y ph a través del cambio de color de un indicador como la Fenolftaleína, Azul de timol, Rojo de metilo, entre otros.
OBJETIVOS
Comprender, reforzar y afianzar los conocimientos adquiridos identificando las falencias de las temáticas y poder superar esos obstáculos mediante los ejercicios y teorías que verán a continuación, por lo tanto este trabajo va con el fin de requerir y facilitar el conocimiento necesario para tener buen uso de cada temática para así mismo a la hora de interactuar con ellas se haga de una correcta y eficaz forma.
MARCO TEÓRICO
NEUTRALIZACIÓN...
Se llama neutralización a la reacción que se produce entre disoluciones acidas y básicas. Todas estas reacciones dan como producto una sal y agua. La palabra "sal" describe cualquier compuesto iónico cuyo catión provenga de una base (Na+del NaOH) y cuyo anión provenga de un ácido (Cl- del HCl). Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor. Se les suele llamar neutralización porque al reaccionar un ácido con una base, estos neutralizan sus propiedades mutuamente.
La ecuación general que representa este tipo de reacción es:
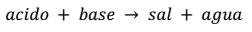

Ejemplo; Paso a paso
HCl + NaOH → NaCl + H2O
Las soluciones acuosas son buenas conductoras de la energía eléctrica, debido a los electrolitos, que son los iones positivos y negativos de los compuestos que se encuentran presentes en la solución.
Una buena manera de medir la conductancia es estudiar el movimiento de los iones en una solución. Cuando un compuesto iónico se disocia enteramente, se le conoce como electrolito fuerte. Son electrolitos fuertes por ejemplo el NaCl, HCl, H2O (potable), etc, en cambio, un electrolito débil es aquel que se disocia muy poco, no produciendo la cantidad suficiente de concentración de iones, por lo que no puede ser conductor de la corriente eléctrica.

Cuando tenemos una disolución con una cantidad de ácido desconocida, dicha cantidad se puede hallar añadiendo poco a poco una base, haciendo que se neutralice la disolución.
Una vez que la disolución ya esté neutralizada, como conocemos la cantidad de base que hemos añadido, se hace fácil determinar la cantidad de ácido que había en la disolución.
En todos los procesos de neutralización se cumple con la “ley de equivalentes”, donde el número de equivalentes del ácido debe ser igual al número de equivalentes de la base:
Nº equivalentes Ácido = nº equivalentes Base
N= nº de equivalentes de soluto / litros de disolución
Los equivalentes dependen de la Normalidad, que es la forma de medir las concentraciones de un soluto en un disolvente, así tenemos que:
N= nº de equivalentes de soluto / litros de disolución
Deduciendo : nº equivalentes de soluto = V disolución . Normalidad

Si denominamos NA, como la normalidad en la solución ácida y NB, la normalidad de la solución básica, así como VA y VB, como el volumen de las soluciones ácidas y básicas respectivamente:
NA.VA= NB. VB
Esta expresión se cumple en todas las reacciones de neutralización. Ésta reacción se usa para la determinar la normalidad de una de las disolución, la ácida o la básica, cuando conocemos la disolución con la que la neutralizamos, añadimos así, poco a poco un volumen sabido de la disolución conocida, sobre la solución a estudiar, conteniendo ésta un indicador para poder así observar los cambios de coloración cuando se produzca la neutralización.
Cambios en sus propiedades.
Las que experimentan cambios se denominan reactivos y los que se forman productos.
De la reacción química formado por un ácido base se obtienen compuestos llamados sales.

LABORATORIO
1.
2.
3.
4.
PH
"Coeficiente que indica el grado de acidez o basicidad de una solución acuosa."
El pH es una medida de la acidez o basicidad de una solución. El pH es la concentración de iones hidronio [H3O+] presentes en determinada sustancia. La sigla significa "potencial de hidrógeno" (pondus Hydrogenii o potentia Hydrogenii; del latín pondus, n. = peso; potentia, f. = potencia; hydrogenium, n. = hidrógeno). Este término fue acuñado por el químico danés Sørensen, quien lo definió como el logaritmo negativo de base 10 de la actividad de los iones hidrógeno. Esto es:
Desde entonces, el término "pH" se ha utilizado universalmente por lo práctico que resulta para evitar el manejo de cifras largas y complejas. En disoluciones diluidas, en lugar de utilizar la actividad del ion hidrógeno, se le puede aproximar empleando la concentración molar del ion hidrógeno.
EJEMPLO
Jugo de limón (pH 2) --------Jugo de naranja (pH 4)
Jugo gástrico (pH 1)----------Cerveza (pH 5)
Detergente (pH 10,5)---- ----Amoníaco (pH 12)
Agua jabonosa (pH 9)--------Lejía (pH 13)
Agua de mar (pH 8)-----------Refresco de cola (pH 3)
¿POR QUÉ ES IMPORTANTE MEDIR EL PH?
El nivel de pH de las sustancias es determinante para que muchas reacciones se lleven a cabo, tanto en los procesos internos de los seres vivos como en la preparación de productos que utilizamos en nuestra vida cotidiana y su comportamiento al contacto con diferentes medios. Por ejemplo, la sangre de los humanos tiene un pH que se encuentra entre 7,35 y 7,45 y fuera de este rango ideal las funciones vitales pueden sufrir alteraciones que nos provoquen hasta la muerte. Conociendo el pH de los alimentos podemos saber si es seguro ingerirlos o no, pues es un valor que refleja si se encuentran en buenas condiciones o si son apropiados para el consumo humano sin representar un riesgo para la salud. De la misma manera, en diferentes procesos industriales como en el teñido de textiles, conocer y controlar el nivel de pH de las sustancias que se utilicen asegurarán el éxito del proceso.
¿CÓMO SE MIDE EL PH?
El pH de una sustancia se puede medir por el método colorimétrico o el potenciométrico. El colorimétrico es más sencillo y utiliza sustancias llamadas indicadores de pH que se pueden encontrar en diferentes presentaciones con propiedades particulares para medir rangos de pH específicos. El indicador más común es el papel tornasol, que se trata de una tira de papel con un tratamiento especial que al sumergirse en una solución cambia de color, ya sea azul para las sustancias alcalinas, o rojo para las soluciones ácidas. Los papeles tornasol se encuentran disponibles para medir diferentes rangos en la escala de pH gracias al compuesto químico con el que están tratados.

(papel tornasol)
Para elegir el indicador de pH adecuado se recomienda conocer el rango aproximado en el que se encuentra la sustancia que se vaya a medir, en caso de que no se sepa este dato es necesario hacer varias mediciones utilizando indicadores con distintas sensibilidades hasta dar con el apropiado. Aunque los papeles tornasol son muy prácticos, si se trabaja con soluciones turbias o coloreadas los datos pueden perder precisión porque fácilmente se puede enmascarar el color, en estos casos es mejor optar por el método potenciométrico, un medidor de pH que utiliza un voltímetro altamente sensible que conectado a dos electrodos generará una corriente eléctrica que varía dependiendo de la concentración de hidrones en la solución.


(tiras de papel indicador)
O utilizando un pHmetro o Potenciometro


INDICADORES
Los indicadores suelen ser ácidos o bases débiles que se caracterizan porque su molécula neutra tiene un color diferente al de la forma iónica. Por lo general, este cambio de color obedece a que la pérdida o ganancia de un H+ por parte del indicador provoca una reorganización interna de los enlaces.
La fenolftaleína, por ejemplo, se comporta como un ácido débil que se disocia de la siguiente forma:
En medio ácido, el equilibrio está desplazado hacia la izquierda, ya que el indicador capta los H+ en exceso, con lo cual predomina la forma incolora. En medio alcalino, los OH- libres consumen los H+ y el equilibrio se desplaza hacia la derecha con lo cual aparecerá la forma coloreada del indicador.
Existe una gran variedad de sustancias indicadoras, cuyo equilibrio disociación es:
En todas ellas, el color de la disolución dependerá de la relación entre las concentraciones de la formas disociada y sin disociar (Figura de la derecha).
En general, el cambio de color se produce en un rango de 2 unidades de pH, y el pKa se sitúa aproximadamente en la mitad de esa zona. En cada caso habrá que utilizar aquella sustancia indicadora cuyo pK se encuentre más próximo al rango de pH donde se pretenden monitorizar los cambios. (Ver figura inferior).
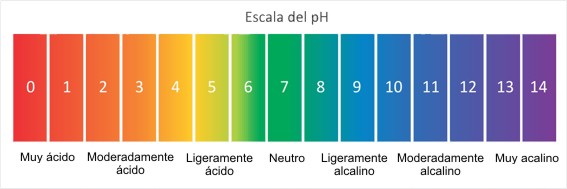
EXPLICACIÓN DE LA ESCALA DEL PH
La escala de pH mide el grado de acidez de un objeto. Los objetos que no son muy ácidos se llaman básicos. La escala tiene valores que van del cero (el valor más ácido) al 14 (el más básico). Tal como puedes observar en la escala de pH que aparece arriba, el agua pura tiene un valor de pH de 7. Ese valor se considera neutro – ni ácido ni básico. La lluvia limpia normal tiene un valor de pH de entre 5.0 y 5.5, nivel levemente ácido. Sin embargo, cuando la lluvia se combina con dióxido de azufre y óxidos de nitrógeno—producidos por las centrales eléctricas y los automóviles—la lluvia se vuelve mucho más ácida. La lluvia ácida típica tiene un valor de pH de 4.0. Una disminución en los valores de pH de 5.0 a 4.0 significa que la acidez es diez veces mayor.

LABORATORIO
1. FENALTEINA
2. UNIVERSAL
3. TORNASOL
TITULACIÓN
"Se utiliza para determinar la concentración desconocida de un reactivo a partir de un reactivo con concentración conocida."
Es el método por el cual se determina una cantidad desconocida de una sustancia particular, mediante la adición de un reactivo estándar que reacciona con ella en proporción definida y conocida.
La adición de un reactivo estándar (un reactivo de concentración conocida y frecuentemente denominado como reactivo titulado) se regula y se mide de alguna forma, requiriéndose un método de indicación para saber cuando la cantidad de reactivo normal juntado y precisamente la suficiente para reaccionar cuantitativamente con la sustancia que se determina.

Como consecuencia, conociendo la proporción en que reaccionan las sustancias y teniendo determinada la cantidad de una sustancia (el reactivo titulado) necesaria para reaccionar en esta proporción, se puede calcular fácilmente la cantidad desconocida de sustancia presente en el frasco de reacción.
En una titulación, el punto en que la cantidad de reactivo titulado adicionado es exactamente suficiente para que se combine en una proporción estequiométrica, o empíricamente reproducible con la sustancia que se determina, se llama punto de equivalencia.
El punto final de una titulación debe coincidir con el punto de equivalencia o estar muy próximo de él. La diferencia entre los puntos de equivalencia y final se llama intervalo del indicador.
Las titulaciones se realizan casi siempre con soluciones o disoluciones, sin embargo también es fácil realizarlas con sustancias en los estados gaseosos, sólido y de fusión, si se dispone de equipo adecuado.
¿CÓMO MEDIR EL PUNTO FINAL?
Se utiliza un indicador que nos permita, a partir de la observación de un cambio de color, conocer el volumen del punto final.
Otra alternativa es medir una propiedad que vaya variando a lo largo de la titulación y graficarla en función del volumen de titulante agregado. Es así que se construyen las curvas de titulación. A partir de las mismas, gráficamente se determina el volumen necesario para alcanzar el punto final.

LABORATORIO
CONCLUSIÓN
Los procesos químicos que fueron mencionados anteriormente, nos llevan a comprender la dinámica en que se dan estas reacciones y la cotidianidad de estos hechos los hace más interesantes y accesibles para estudiarlos, por ende es importante conocer, indagar e ir más a fondo para con ello lograr grandes cosas como un proceso correcto a la hora de relacionarse con esos tipos de ejercicios, por lo tanto se puede concluir que este trabajo logra despejar algunas dudas e inquietudes sobre los temas que fueron nombrados al comienzo.
WEBGRAFÍA
NEUTRALIZACIÓN
https://www.tplaboratorioquimico.com/quimica-general/acidos-y-bases/neutralizacion.html
http://lachuspaquimica.blogspot.com/2011/05/neutralizacion-y-ph-soluciones.html
https://quimica.laguia2000.com/reacciones-quimicas/reacciones-de-neutralizacion
https://quimica-reacciones-quimicas.webnode.mx/neutralizacion/
PH
http://www.ehu.eus/biomoleculas/ph/medida.htm
http://elcrisol.com.mx/que-es-y-como-se-mide-el-ph/
http://quimicatorin.blogspot.com/2012/01/escala-de-ph.html
http://cpa-quimica.blogspot.com/2009/06/el-ph-y-el-poh.html
https://www.ejemplos.co/20-ejemplos-del-ph-de-sustancias/
TITULACIÓN
https://es.slideshare.net/MichaelAlex/titulaciones-acidobase
https://quimica.laguia2000.com/conceptos-basicos/titulacion
http://docencia.udea.edu.co/cen/QuimicaAnaliticaI/volu.htm
https://www.ejemplode.com/38-quimica/4730-ejemplo_de_titulacion_quimica.html
FALTO MAS MARCO TEORICO Y LOS INFORMES ERAN POR SEPARADO 4,0
ResponderEliminar