BALANCEO DE ECUACIONES QUÍMICAS
LAURA SOFÍA FLOR TRIANA
DIANA FERNANDA JARAMILLO
INSTITUCION EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
QUÍMICA
IBAGUÉ TOLIMA
10-2
2018
INTRODUCCIÓN
"Una Ecuación Química es la representación gráfica o simbólica de una reacción que muestra las transformaciones que sufren las sustancias,elementos o compuestos" Es decir, los átomos en una ecuación química deben obtener el mismo número de átomos en los reactivos y productos, para poder aplicarlo correctamente podemos usar varias formas como: el método redox, método de ion- electrón balanceo algebráico, y el método de tanteo.
El presente trabajo tiene como fin dar a conocer más a fondo sobre las ecuaciones quimicas, por ende hablaré acerca de cada una y veremos las partes que la conforman.
OBJETIVO
Comprender, reforzar y afianzar los conocimientos adquiridos identificando las falencias de las temáticas y poder superar esos obstáculos mediante los ejercicios y teorías que verán a continuación.
MARCO TEÓRICO
¿QUÉ ES BALANCEO DE ECUACIONES?
Es la manera de representar una reacción química, esta utiliza una serie de símbolos químicos para mostrar que sucede en dicha reacción. El balanceo de ecuaciones químicas implica que todos los elementos presentes en dicha ecuación tienen el mismo número de átomos a cada lado. Para lograr esto se hace necesario utilizar los métodos de balanceo para asignar los coeficientes estequiométricos adecuados a cada especie presente en la reacción.

MÉTODOS DE BALANCEO DE ECUACIONES QUÍMICAS
- BALANCEO POR TANTEO: Se basa en la estequiometría de la reacción y se trata de intentar con distintos coeficientes con el fin de equilibrar la ecuación, siempre que se escojan los números enteros más pequeños posibles con los que se obtenga el mismo número de átomos de cada elemento a ambos lados de la reacción.
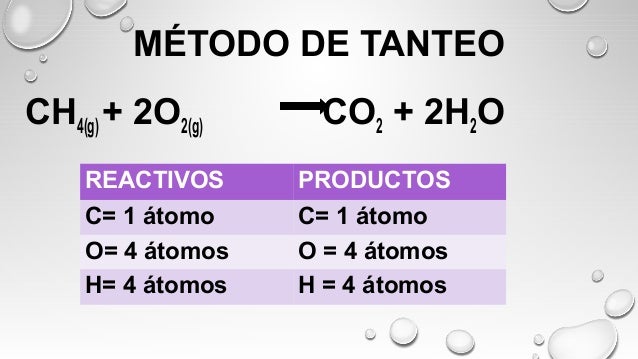
1. El coeficiente de un reactante o producto es el número que precede su fórmula, y es el único número que puede ser cambiado cuando se realiza el balanceo de una ecuación, puesto que si se cambian los subíndices de las fórmulas se estaría cambiando la identidad del compuesto en cuestión
2.Contar y comparar, Después de haber identificado cada elemento de la reacción y colocarlo del lado correcto, se procede a contar y comparar el número de átomos de cada elemento presente en la ecuación y determinar aquellos que deben ser balanceados
3.Luego, se continúa con el balanceo de cada elemento (uno a la vez), al colocar coeficientes enteros precediendo cada fórmula que contenga elementos sin balancear. Normalmente se balancean en primer lugar los elementos metálicos, luego los no metálicos y por último los átomos de oxígeno e hidrógeno.
EJEMPLO: Balancear la siguiente ecuación
¿Cuántos oxígenos hay en el primer miembro? Encontramos 4 porque 3 mas 1 es igual a 4
Y ¿Cuántos en el segundo? Encontramos 6 porque el dos (situado a la izquierda del Fe) se multiplica por el subíndice encontrado a la derecha del paréntesis final y se multiplica 2*3 = 6
Por lo tanto en el segundo miembro hay 6 oxígenos.
Entonces colocamos un 3 del lado izquierdo del hidrógeno en el primer miembro para tener 6 oxígenos
Por último la ecuación queda de esta manera
- BALANCEO ALGEBRAICO: Para utilizar este método se establece un procedimiento para tratar los coeficientes de las ecuaciones químicas como incógnitas del sistema que deben ser resueltas.

1. En primer lugar se toma como referencia un elemento específico de la reacción y se colocan los coeficientes como letras (a, b, c, d…), que representan las incógnitas, de acuerdo con los átomos existentes de ese elemento en cada molécula (si una especie no contiene ese elemento se coloca “0”).
2.Luego de obtener esta primera ecuación se determinan las ecuaciones para los demás elementos presentes en la reacción; habrá tantas ecuaciones como elementos existan en dicha reacción.
3.Por último, se determinan las incógnitas por uno de los métodos algebraicos de reducción, igualación o sustitución y se obtienen los coeficientes que den como resultado la ecuación correctamente balanceada.
EJEMPLO: Balancear la siguiente ecuación
Aplicamos el segundo paso: Ca, C, O, H
Continuamos con el tercer paso:
Ca: (Ca está en "a" del primer miembro y en "c" en el segundo por lo tanto) a=c
C: (C está 2 veces en "a" y 2 veces en "d" por lo tanto) 2a = 2d
O: (O está en "b" y 2 veces en "c" por lo tanto) b = 2c
H: (H está 2 veces en "b", 2 en "c" y 2 veces en "d" por lo tanto) 2b = 2c + 2d
Le asignaremos el valor de "1" a C
OBTENIENDO EL SIGUIENTE RESULTADO
- BALANCEO DE ECUACIONES REDOX (MÉTODO ION-ELECTRÓN): Primero se coloca la reacción general (desbalanceada) en su forma iónica. Luego se divide esta ecuación en dos semirreacciones, la de oxidación y la de reducción, balanceando cada una de acuerdo al número de átomos, su tipo y las cargas de estos.

Por ejemplo, para las reacciones que se dan en medio ácido, se agregan moléculas de H2O para equilibrar los átomos de oxígeno y se añade H+ para balancear los átomos de hidrógeno.
En cambio, en medio alcalino se añade un número igual de iones OH– en los dos lados de la ecuación por cada ion H+, y donde surjan iones H+ y OH– se unen para formar moléculas de H2O.
1. Agregar electrones, se deben agregar tantos electrones como sean necesarios para balancear las cargas, después de equilibrar la materia en cada semirreacción
2. Posteriormente al balanceo de cada semirreacción, estas se suman y se culmina balanceando la ecuación final por tanteo. En caso de que se presente una diferencia en el número de electrones de las dos semirreacciones, debe multiplicarse una o ambas por un coeficiente que iguale este número
3. Finalmente, debe corroborarse que la ecuación comprende la misma cantidad de átomos y el mismo tipo de estos, además de poseer las mismas cargas en los dos lados de la ecuación global.
EJEMPLOS: Balancear la siguiente ecuación
Si vemos la primera regla, esta nos dice que todos los elementos libres tendrán valencia cero, entonces vemos la ecuación y localizamos a los elementos libres, en este caso son el fierro y el hidrógeno, colocamos un cero como valencia.
Continuamos con las demás reglas y encontramos a los oxígenos e hidrógenos y les asignamos la valencia que les corresponde, establecidas en las reglas:
Para continuar, obtenemos la valencia de los elementos que nos sobran, en este caso el azufre y el fierro:
Ubiquémonos en el azufre (S) del primer miembro en la ecuación
y posteriormente obtendremos la valencia del azufre. Quede claro que la del hidrógeno y la del oxígeno ya la tenemos.
Para obtener la valencia del azufre, simplemente (pon mucha atención aquí) vamos a multiplicar la valencia del oxígeno por el número de oxígenos que hay. (En este caso hay 4 oxígenos) y hacemos lo mismo con el hidrógeno, multiplicamos su valencia por el número de oxígenos que hay. Queda de la siguiente manera
Ya que tenemos los resultados, ahora verificamos que todo elemento químico es eléctricamente neutro y lo comprobamos de la siguiente manera:
Tenemos que llegar a cero. Buscamos cuanto falta de dos para ocho. Entonces encontramos que faltan 6, este número será colocado con signo positivo +
El 6 que acabamos de obtener es la valencia del azufre en el primer miembro.
Ubiquémonos en el fierro del segundo miembro en donde se encuentra el compuesto
Localizamos al fierro. Para obtener su valencia primero denominamos si es monovalente o divalente etc. Ya que vimos que es divalente, necesitamos saber la valencia del radical sulfato, en este caso es
Para obtener la valencia del fierro, multiplicamos la valencia del radical (-2) con el subíndice que se encuentre fuera del mismo
Después lo dividimos entre el número de fierros que hay en el compuesto (en este caso hay dos fierros)
Queda de la siguiente manera:
2 * 3 = 6 6/2 = 3
El tres que acabamos de obtener es la valencia del fierro.
Que nos quede claro, ya tenemos la valencia del fierro que es 3, ya tenemos la valencia del oxígeno que es -2, ahora nos falta la valencia del azufre (S) lo cual realizaremos algo similar con lo dicho con anterioridad:
Multiplicamos la valencia del radical sulfato (-2) con el subíndice (3) y después con el número de oxígenos que hay dentro del paréntesis (4).
Obtenemos un total de 24. Este número que resultó se le llama valencia parcial
Después continuamos con el fierro. Ahora ya que tenemos que la valencia del fierro es 3 entonces multiplicamos la valencia por el numero de fierros que hay (hay 2)
Y nos da un resultado de 6.
Entonces:
Tenemos 6 y tenemos -24, de 6 a 24 ¿Cuánto falta?
Respuesta: +18
Ahora el 18 lo dividimos entre el número de azufres que hay: nos da un total de 6 o sea +6.
Y de esta manera ya obtuvimos todas las valencias del compuesto químico:
Ahora, vamos a verificar cuál elemento se oxida y cual se reduce, para esto, chequemos las valencias de los elementos, debemos verificar que en los dos miembros estén iguales.
Si vemos al fierro en el primer miembro y luego lo vemos en el segundo. Encontramos que sus valencias ya no son las mismas por tanto el elemento se está oxidando porque aumenta su valencia de cero a 3
Ahora, si nos fijamos en el hidrógeno del primer miembro, se está reduciendo con el hidrógeno del segundo miembro:
Entonces la ecuación queda de la siguiente manera:
Ahora, para poder completar el balanceo, (atención) vamos a intercambiar los números que se oxidaron o redujeron. Esto es el 3 y el 1.
El 3 lo colocaremos en el lugar del 1 y el 1 en el lugar del 3
Estos números resultantes se colocan de lado izquierdo de los elementos que se oxidaron o redujeron.
El número 1 (que por lo general no se escribe) se coloca de lado izquierdo del fierro en los dos miembros.
El número 3 se coloca de lado izquierdo del hidrógeno en los dos miembros quedando de la siguiente forma:
Entonces de esta manera podemos deducir que la ecuación está balanceada, pero, no es así, uno de los pasos para terminarla es: "Una vez obtenidos los números de la ecuación, se completará con método de tanteo".
Verificamos si así está balanceada:
1= Fe =2
3= S =3
12= O =12
6= H =6
PROCEDIMIENTOS
(PÁGINA WEB DE ECUACIONES)
NIVEL 1
NIVEL 2
NIVEL 3
CONCLUSIÓN
- Este trabajo nos ayudó para familiarizarnos más con el tema de balanceo de ecuaciones químicas con el metodo de tanteo y oxido reducción por los ejercicios planteados. Finalmente sabemos que las reacciones químicas representan un evento de la realidad, porque, siguen una ley universal “la materia no se crea ni se destruye solo se transforma”.
WEBGRAFÍA
- https://www.guao.org/sites/default/files/biblioteca/Balanceo%20de%20ecuaciones%20qu%C3%ADmicas_0.pdf.
- http://www.monografias.com/trabajos83/balanceo-ecuaciones-quimicas/balanceo-ecuaciones-quimicas.shtml
- https://www.lifeder.com/balanceo-ecuaciones-quimicas/
- http://www.monografias.com/trabajos83/balanceo-ecuaciones-quimicas/balanceo-ecuaciones-quimicas.shtml
- https://ciencias-quimica-y-biologia.webnode.es/news/balanceo-por-redox/
FALTO OPCIONES DE MAYOR NIVEL EN EL JUEGO DE BALANCEO 4.8
ResponderEliminar