REACCIONES QUÍMICAS
LAURA SOFÍA FLOR TRIANA
DIANA FERNANDA JARAMILLO
INSTITUCION EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
QUÍMICA
IBAGUÉ TOLIMA
10-2
2018
Introducción
Como toda acción tiene una reacción en el área de la ciencia podemos observar diferentes tipos de estas como son las comúnmente Reacciones Químicas la cuales son procesos químicos donde las sustancias intervienen y sufren cambios en sus estructura, para dar origen a otras. Éstas nos permiten el conocimiento necesario para operar correctamente cada ecuación.
Objetivo
El presente documento tiene el fin de requerir y facilitar e identificar qué es una reacción química, sus clases y características, vamos a profundizarnos y saber más allá de las mismas preguntas, saber interactuar con lo que sabemos, y querer aprender mucho más, dando a entender las ecuaciones químicas, y cómo se resuelve.cada una.
¿QUÉ ES UNA REACCIÓN QUÍMICA?
Es un proceso químico en el cual dos sustancias o más, denominados reactivos, por la acción de un factor energético, se convierten en otras sustancias designadas como productos. Las sustancias pueden ser elementos químicos (materia constituida por átomos de la misma clase) o compuestos químicos (sustancia que resulta de la unión de dos o más elementos de la tabla periódica). Y estos sufren cambios en su estructura para dar origen a otras sustancias. El cambio es más fácil entre sustancias líquidas o gaseosas, o en solución, debido a que se hallan más separadas y permiten un contacto más íntimo entre los cuerpos reaccionantes.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.


Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.
CARACTERÍSTICAS DE LAS REACCIONES QUÍMICAS
- La o las sustancias nuevas que se forman suelen presentar un aspecto totalmente diferente del que tenían las sustancias de partida.
- Durante la reacción se desprende o se absorbe energía:
A. Reacción exotérmica: se desprende energía en el curso de la reacción.
B.Reacción endotérmica: se absorbe energía durante el curso de la reacción.
- Se cumple la ley de conservación de la masa: la suma de las masas de los reactivos es igual a la suma de las masas de los productos. Esto es así porque durante la reacción los átomos ni aparecen ni desaparecen, sólo se reordenan en una disposición distinta. http://www.quimicaweb.net/grupo_trabajo_fyq3/tema6/index6.htm

EJEMPLOS DE LAS REACCIONES QUÍMICAS

SIGNIFICADOS DE LAS ECUACIONES QUÍMICAS
Una reacción química se representa mediante una ecuación química. Para leer o escribir una ecuación química, se deben seguir las siguientes reglas:
- Las fórmulas de los reactivos se escriben a la izquierda, y las de los productos a la derecha, separadas ambas por una flecha que indica el sentido de la reacción.
- A cada lado de la reacción, es decir, a derecha y a izquierda de la flecha, debe existir mismo número de átomos de cada elemento
- Cuando una ecuación química cumple esta segunda regla, se dice que está ajustada o equilibrada. Para equilibrar reacciones químicas, se ponen delante de las fórmulas unos números llamados coeficientes, que indican el número relativo de átomos y moléculas que intervienen en la reacción.
ECUACIONES QUÍMICAS
Son expresiones matemáticas abreviadas que se utilizan para describir lo que sucede en una reacción química en sus estados inicial y final. En ella figuran dos miembros; en el primero, los símbolos o fórmulas de los reactantes, reaccionantes o reactivos y en el segundo los símbolos o fórmulas de los productos. Para separar ambos miembros se utiliza una flecha que generalmente se dirige hacia la derecha, indicando el sentido de la reacción:
A + BC AB + C
EJEMPLO: La ecuación química que describe la reacción entre el magnesio y el oxígeno es:
2 Mg + O2 2 MgO Reactantes Producto
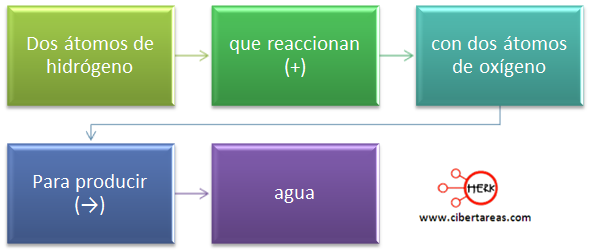
H2 (g) + O2 (g) e H2O (l)
reactivos productos
que se lee "el hidrógeno gas reacciona con el oxígeno gas para daer agua líquida" .
Por ejemplo si ponemos en contacto gas oxígeno y gas hidrógeno en las condiciones adecuadas reaccionarán para dar agua líquida. En este ejemplo el oxígeno y el hidrógeno, que son las sustancias que hay inicialmente y que van a "desaparecer" decimos que son las sustancias que reaccionan o los reactivos y el agua que es la nueva sustancia, la que "aparece", decimos que es el producto.
También sabes que los químicos utilizan símbolos para simplificar los nombres de las sustancias puras, las fórmulas químicas. De la misma manera en lugar de describir las reacciones químicas con palabras como he hecho en el ejemplo anterior lo hacen de manera simbólica en lo que se conoce como ecuación química. La ecuación química de nuestra reacción entre el oxígeno y el hidrógeno es:
reactivos productos
que se lee "el hidrógeno gas reacciona con el oxígeno gas para daer agua líquida" .
SIGNIFICADOS DE LAS ECUACIONES QUÍMICAS
a) Cualitativo: Indica la clase o calidad de las sustancias reaccionantes y productos. En la ecuación anterior, el magnesio reacciona con el oxígeno para obtener óxido de magnesio
b) Cuantitativo: Representa la cantidad de átomos, moléculas, el peso o el volumen de los reactivos y de los productos.
En la ecuación química anterior, se entiende que dos moléculas (o moles) de magnesio, reaccionan con una molécula ( o mole) de oxígeno para obtenerse dos moléculas ( o moles) de óxido de magnesio. También se puede calcular la cantidad en gramos del producto, tomando como base los pesos atómicos de los reaccionantes (Con ayuda de la Tabla Periódica) .

Tipos de Reacciones Químicas
A) De acuerdo a las sustancias reaccionantes:
masa molecular
Cuando una sustancia compleja por acción de diferentes factores, se descompone en otras más sencillas:
Ej. : Cuando las descompone el calor, se llaman también de disociación térmica.
Reacciones de simple sustitución:
Denominadas también de simple desplazamiento cuando una sustancia simple reacciona con otra compuesta, reemplazando a uno de sus componentes.
Ej:
Reacciones de doble sustitución:
También se denominan de doble desplazamiento o metátesis y ocurren cuando hay
intercambio de elementos entre dos compuestos diferentes y de esta manera originan nuevas sustancias. * Se presentan cuando las sustancias reaccionantes están en estado iónico por encontrarse en solución, combinándolos entre sí sus iones con mucha facilidad, para formar sustancias que permanecen estables en el medio reaccionante:
Ej. :
Reacciones Reversibles:
Cuando los productos de una reacción pueden volver a reaccionar entre sí, para generar los reactivos iniciales. También se puede decir que se realiza en ambos sentidos.
Ej. :
Reacciones Irreversibles:
Cuando los productos permanecen estables y no dan lugar a que se formen los reactivos iniciales.
Ej. :
Toda reacción es más o menos reversible; pero en muchos casos esta reversibilidad es tan insignificante que se prefiere considerar prácticamente irreversible.
B) De acuerdo a su energía:
En toda reacción química hay emisión o absorción de energía que se manifiesta como luz y/o calor. Aquí aparece el concepto de Entalpía, entendida como la energía que se libera o absorbe.
Reacciones Exotérmicas:
Cuando al producirse, hay desprendimiento o se libera calor.
Ej. :
Reacciones Endotérmicas:
Cuando es necesario la absorción de calor para que se puedan llevar a cabo.
Ej. :
La energía liberada o absorbida se denomina calor de reacción o entalpía (H) por consiguiente:
En una reacción exotérmica la entalpía es negativa
En una reacción endotérmica la entalpía es positiva
C) Reacciones Especiales:
Reacción de Haber:
Permite obtener el amoniaco partiendo del hidrógeno y nitrógeno
sustancias:
N2 + 3H2 ? 2NH3
Reacción Termoquímica:
En estas reacciones se indica la presión, temperatura y estado físico de las
Reacción de Combustión:
En estas reacciones, el oxígeno se combina con una sustancia combustible y como consecuencia se desprende calor y/o luz. Las sustancias orgánicas pueden presentar reacciones de combustión completa o incompleta:
- R. Completa: Cuando se forma como producto final CO2 y H2O (en caso de sustancias orgánicas)
Ej. :
R. Incompleta: Cuando el oxígeno no es suficiente, se produce CO y H2O, aunque muchas veces se produce carbón.
Reacción Catalítica:
Se acelera por la intervención de sustancias llamadas catalizadores que permanecen inalterables al final de la reacción.
Catalizador: Sustancia que acelera la reacción. No reacciona. Se recupera todo
Ej. :
Reacción REDOX:
Reacciones en donde hay variación de los estados de oxidación de las sustancias por transferencia de electrones.
Consiste en la reacción de un ácido con una base.
1.Mecanismo de Reacción:
Definición: Son las etapas en que ocurre una reacción química. La mayoría de las reacciones ocurren en varias etapas consecutivas, cada una de las cuales se denomina reacción elemental; el conjunto total de estas reacciones elementales, por las que transcurre una reacción global, se denomina mecanismo de reacción.
Según Fco. A. Villegas (Univ. de Colombia), para que se produzca una reacción química tal como: 
Se requiere una serie de etapas intermedias o etapas sucesivas y simultáneas . Un posible mecanismo para la reacción mencionada es el siguiente:
En la primera etapa la molécula de A2 se descompone en dos átomos iguales de manera rápida.
En la segunda etapa, la más lenta de todo el proceso, la molécula de B2 se divide también en dos átomos .
En las etapas tercera y cuarta y que ocurren de manera simultánea, un átomo de A, se combina con un átomo de B, para formar el compuesto AB de manera más rápida que la etapa segunda.
La suma algebraica de todas las etapas, resulta la reacción neta.
Como se aprecia, cuando una reacción ocurre en varias etapas, generalmente una de ellas, es más lenta que las demás, actuando como reguladora de la velocidad de reacción global,, tomando por ello el nombre de etapa determinante o controlante de la velocidad de reacción.
Ej. :
La reacción entre el cloruro de yodo y el hidrógeno, para formar yodo y cloruro de hidrógeno, si se realizara en una sola etapa, sería de tercer orden ( de segundo orden respecto al ICl y de primero respecto al H2), pero se ha encontrado experimentalmente que la reacción es de primer orden para ambos reactivos, y por tanto, de segundo orden global. Esto se puede entender suponiendo que la reacción ocurre en dos partes o etapas, como las siguientes:
2. Reacciones en Cadena:
Existen diversas reaccione químicas que ocurren en varias etapas, en las que además de formarse los productos, se regeneran los reactantes que dieron inicio a la reacción, formándose una especie de "cadena" en la que se repiten los eslabones, por lo que reciben el nombre de Reacciones en cadena.
En estas reacciones es frecuente la intervención de radicales libres, esto es, moléculas o átomos que tienen normalmente una valencia sin saturar.
Ej. : En la descomposición térmica del acetaldehído ocurre lo siguiente:
a) CH3CHO CHO + CH3 (iniciación)
b) H3CHO + CH3 CH4 + CO + CH3 (propagación)
c) 2CH3 CH3 CH3 (terminación)
1. El primer proceso, es una descomposición del acetaldehído en radicales formaldehído y metilo, produciéndose la reacción de iniciación de la cadena , (donde una molécula absorbe energía en forma de calor, luz o radiación ultravioleta) dando inicio al proceso total y produciéndose además radicales metilo, que son los portadores de la cadena y que tras el segundo proceso, llamado de propagación de la cadena, ( se lleva a cabo mediante el proceso de los radicales libres, uniendo dos elementos y dejando uno libre)puede causar la descomposición de muchas moléculas de acetaldehído.
2. Si no fuera por la reacción tercera, llamada de terminación de la cadena,(los átomos se unen y forman moléculas) en donde se combinan entre sí los dos radicales metilo, la reacción no concluiría hasta terminar todo el acetaldehído, porque un solo radical metilo lo podría descomponer todo, puesto que al hacerlo según el segundo proceso, se regenerará metilo. También se puede considerar la cadena inhibidora cuando un átomo choca con determinada molécula inhibiendo toda la reacción. Veamos otro ejemplo:
CONCLUSIÓN
Al concluir nos damos cuenta que una reacción química es todo aquello donde una o más sustancias tienen ciertas transformaciones, a medida que vamos comprendiendo este trabajo vemos que una ecuación química es una descripción simbólica y deben quedar balanceadas.
WEBGRAFÍA
- http://www.monografias.com/trabajos88/ecuaciones-y-reacciones-quimicas/ecuaciones-y-reaccionesquimicas.shtml#Comentarios#ixzz5D3uF2cXd
- https://es.wikipedia.org/wiki/Reacci%C3%B3n_qu%C3%ADmica
- http://www.monografias.com/trabajos88/ecuaciones-y-reacciones-quimicas/ecuaciones-y-reacciones-quimicas.shtml#ixzz5Cl7lui79
- https://www.definicionabc.com/ciencia/reaccion-quimica.php
- http://reaccionquimica04.blogspot.com.co/2012/11/clases-dereacciones-quimicas-podemos.html
- http://www.lostipos.com/de/ecuaciones_quimicas.html
No hay comentarios:
Publicar un comentario