FENOLES Y ALCOHOLES
LAURA SOFÍA FLOR TRIANA
LAURA SOFÍA FLOR TRIANA
DIANA FERNANDA JARAMILLO
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
QUÍMICA
IBAGUÉ TOLIMA
11-2
2019
INTRODUCCIÓN
La química orgánica, como parte pilar dentro de una ciencia tan experimental como lo es la química Se llevan a tratar una serie de procesos y manejos de diversas técnicas. Por consiguiente es importante saber que tanto alcoholes como fenoles contienen un grupo funcional de OH.
Los ALCOHOLES se derivan en los hidrocarburos saturados o no saturados al sustituir por los menos un H con OH, y los FENOLES se derivan de los hidrocarburos aromáticos al sustituir por lo menos un H con OH los ALCOHOLES Y FENOLES contituyen una gama amplia de sustancias de gran importancia a nivel industrial como materia prima para medicamentos, licores, polimeros, como solventes polares y en la sintesis de otros compuestos organicos.
OBJETIVOS ESPECÍFICOS
⇒Identificar algunas de las propiedades físicas de los alcoholes y fenoles; estado natural, color, olor, solubilidad en agua y en otros solventes.
⇒Reconocer el grupo funcional (-OH) presente en los alcoholes y fenoles por medio de reacciones químicas.
⇒Clasificar los alcoholes en primarios, secundarios, y terciarios. A partir de reacciones químicas.
⇒Comprobar experimentalmente las principales reacciones de alcoholes y fenoles.
OBJETIVOS GENERALES
Comprender, reforzar y afianzar los conocimientos adquiridos identificando las falencias de las temáticas y poder superar esos obstáculos mediante los ejercicios y teorías que verán a continuación, por lo tanto este trabajo va con el fin de requerir y facilitar el conocimiento necesario para tener buen uso de cada temática y así mismo a la hora de interactuar con ellas se haga de una correcta y eficaz forma.
MARCO TEÓRICO
FENOLES
➤Son compuestos orgánicos oxigenados q resultan de sustituir átomos de hidrogeno del núcleo bencénico por e gripo de hidroxilo.
➤Su formula general es Ar-OH
➤Donde Ar significa radical bencénico o grupo aromático
➤Son diferentes de los alcoholes; aunque poseen el grupo funcione al OH.
➤Los más sencillos son líquidos pero también pueden ser sólidos
➤Poseen altos puntos de ebullición porque forman puentes de hidrogeno
➤Son insolubles en agua(H2O); (con algunas excepciones ej. Fenol que tiene poca solubilidad en H2O)
➤Son incoloros
➤Se oxidan fácilmente (adquieren color)
CLASIFICACIÓN
Según el numero de OH presentes en el anillo bencénico los fenoles se clasifican en:

Nomenclatura
Monofenoles: se enumeran los carbonos del anillo bencénico empezando por la ubicación del OH, sí tiene un sustituyentes se indica con números o con letras O, M, P que indicara la posición de los otros radicales o sustituyentes que se nombraran antes de la palabra fenol
| p- bromo fenol / 4-bromo fenol |
Difenoles y trifenoles: se enumera el anillo a partir de un OH, se nombra la posición de los radicales o sustituyentes del OH, y luego las posiciones de os OH terminando el nombre en difenol o trifenol según sea el caso.

| 2-bromo, 5-yodo, 1,4 difenol |

| 2- etil, 5-metil 4-ciclopentil 1,3,6-trifenol |
Usos y aplicaciones
En términos de su uso medicinal el fenol tiene 4 propiedades que vale la pena señalarlas
➩Capacidad para actuar como antiséptico y desinfectante
➪Capacidad para actuar como anestésico local
➩Irritante para la piel
➩Toxicidad cuando se ingiere
Debido a los dos últimos el fenol solo se encuentra en cantidades muy pequeñas en medicamentos que se venden son receta medica
Por su actividad antiséptica y anestésica los fenoles se encuentran comercialmente en jabones, desodorantes, ungüentos, desinfectantes, rocíos para primeros auxilios, gárgaras, pastillas y fricciones músculos.
En el laboratorio se utilizan porque es un buen disolvente para la síntesis de otros compuestos orgánicos
Propiedades de los fenoles
1) Los alcoholes y los fenoles tienen casi la misma geometría del agua alrededor del átomo de oxígeno. El ángulo del enlace R_O_H tiene aproximadamente un valor tetraédrico (por ejemplo, 109° en el metanol), y el átomo de oxígeno tiene hibridación sp3.
2) También como el agua, los alcoholes y los fenoles tienen puntos de ebullición altos que podrían esperarse debido al enlace por puente de hidrógeno. Un átomo de hidrógeno del _OH polarizado positivamente de una molécula es atraído a un par de electrones no enlazado en el átomo de oxígeno electronegativo de la otra molécula, lo que resulta en una fuerza débil que mantiene juntas a las moléculas. Deben superarse estas atracciones intermoleculares para liberarse del líquido y entrar al estado gaseoso, por lo que se incrementa la temperatura de ebullición. (McMurry, 2008).
3) Los fenoles son más ácidos que los alcoholes debido a que el anión fenóxido está estabilizado por resonancia. La deslocalización de la carga negativa sobre las posiciones orto y para del anillo aromático resulta en la estabilidad incrementada del anión fenóxido en relación al fenol no disociado y en un G° consecuentemente bajo para la disociación. (McMurry, 2008).
4) Los fenoles sustituidos pueden ser más ácidos o menos ácidos que el fenol, dependiendo si el sustituyente es a tractor de electrones o donador de electrones. Los fenoles con un sustituyente atractor de electrones son más ácidos debido a que estos sustituyentes deslocalizan la carga negativa; los fenoles con un sustituyente donador de electrones son menos ácidos debido a que estos sustituyentes concentran la carga negativa. El incremento en la acidez de los fenoles por un sustituyente atractor de electrones se nota particularmente en los fenoles con un grupo nitro en la posición orto o para. (McMurry, 2008).
Los fenoles más sencillos son líquidos o sólidos blandos e incoloros y se oxidan con facilidad por lo que se encuentran coloreados.
5) En presencia de impurezas o bajo influencia de la luz, el aire y ciertos compuestos como el cobre y el hierro, el fenol puede teñirse de amarillo, marrón o rojo. El fenol es poco soluble en agua ya que aunque presentan el puente de hidrógeno, la proporción de carbonos con respecto a la cantidad de –OH es muy baja.
PROPIEDADES QUÍMICAS
Están influenciadas por su estructura, CONSTANTE DE ACIDEZ los fenoles son ácidos más fuertes que el agua y los alhocoles pero más debules que los ácidos carboxílicos. LOS FENOLES representan 5 estructuras contribuyentes es decir que pueden ceder protones.
1) Reaccion por rompimiento de enlace o-h.
A) Reduccion acido base: Los alcoholes son acidos muy debiles, pues su constante de disociacion es menor de la del agua y deben ser atacados por bases muy fuertes.
B) Reaccion especie nucleofilica: Los alcoholes actuan como especies nucleofilicas en reacciones de sustitucion. Tambien actuan asi cuando reaccionan con aldehidos y cetonas.
C) Rompimiento enlace carbono- oxigeno: Se presenta cuando los alcoholes actuan como sustratos en reacciones de sustitucion. Estas reacciones son similares a las de los haluros de alquilo.
D) Reacciones con H2SO4: Dependiendo de las codiciones de temperatura y concentracionel H2SO4 y actua diferenciando productos asi:
A) Soluciones divididas a baja temperatura producen sulfatos acido o sulfatos neutros.
B) A temperatura de 140ºc el H2SO4 cataliza la formacion de eteres simetricos.
C) A temperaturas superiores a 150ºc se prodecu la eliminacion.
E) Formacion de haluros: Los alcoholes no son atacados por halogenos directamente sino formando reacciones lentas.
CUADRO COMPARATIVO DE PROPIEDADES FÍSICAS Y QUÍMICAS

MÈTODOS DE OBTENCIÒN:
A) El metanol se obtiene colentando el HH2 y CO de catalizadores minerales.
B) El etanol por fermentacion de carbohidratos en presencias de levaduras.
C) Los demas alcoholes se preparan por reduccion de aldehidos, cetonas de acidos carboxilicos.
D) Los fenoles se obtinen apartir de qumeno ò isopropilbenceno.
REACCIONES DE LOS FENOLES
➙Reacciones de sustitución electrofílica aromática
➙El grupo hidroxilo es un sustituyente activador fuerte en las reacciones de sustitución electrofilica aromática. Los fenoles son sustratos muy reactivos para la halogenación, la nitración y la sulfonación electrofilicas, y las reacciones de Friede_Crafts.
➙Oxidación de fenoles: quinonas
➙Los fenoles no se oxidan de la misma forma que los alcoholes, porque no tienen un átomo de hidrogeno en el carbono que tiene el hidroxilo. La reacción de un fenol con los agentes oxidantes energéticos produce una 2,5-ciclohexadieno-1,4 –diona o quinona.
ALCOHOLES
Los alcoholes son compuestos organicos que contienen un grupo
hidrocilo (-OH), que se encuentran unido a una cadena hidrocarbonada a través
de un enlace covalente a un átomo de carbono hibiracion sp3, mientras que los
compuestos que poseen un grupo hidroxilo unido a uno de los atomos de carbono
de un doble enlace se conocen como fenoles, y los compuestos que contienen un
grupo hidrocilo unido a un anillo de benceno se llaman fenoles; Los alcoholes
son aquellos hidrocarbutos saturados o alcanos que contienen uno, dos o tres
grupos hidroxilo (OH) en sustitución de un átomo de hidrógeno enlazado a una
forma covalente
Ejemplo: metil (CH3-) + OH = CH3-OH (metanol)
CLASIFICACIÓN
Los alcoholes se clasifican en primarios, secundarios y terciarios, dependiendo del carbono funcional al que se una el grupo hidroxilo.
➥Alcohol primario: se utiliza la Piridina (Py) para detener la reacción en el aldehído Cr03 / H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico.
➥Alcohol secundario: se obtiene una cetona + agua.
➥Alcohol terciario: si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza uno enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano.
Y a su vez los alcoholes se pueden clasificar según el número de grupos hidroxilos que contenga el compuesto:
➧Monoalcohol o Monol: Son alcoholes que tienen un solo grupo hidroxilo (–OH), y son aquellos que pueden clasificarse como alcoholes primarios, secundarios y terciarios.
➧ Polialcoholes: Son compuestos que tienen dos o más grupos hidroxilos (–OH).
NOMENCLATURA
1. Se elige como cadena principal la de mayor longitud que contenga el grupo -OH.
2. Se numera la cadena principal para que el grupo -OH tome el localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas carbonadas, halógenos, dobles y triples enlaces.
3. El nombre del alcohol se construye cambiando la terminación -o del alcano con igual número de carbonos por -ol
4. Cuando en la molécula hay grupos grupos funcionales de mayor prioridad, el alcohol pasa a serun mero sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y cetonas.
5. El grupo -OH es prioritario frente a los alquenos y alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la molécula termina en -ol.
PROPIEDADES FÍSICAS DE LOS ALCOHOLES
Se basan principalmente en su estructura. El alcohol esta compuesto por un alcano y agua. Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua), similar al agua. De estas dos unidades estructurales, el grupo –OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que las modifica, dependiendo de su tamaño y forma.

PROPIEDADES QUÍMICAS DE LOS ALCOHOLES
Reacción como bases El grupo hidroxilo de los alcoholes puede ser reemplazado por diversos aniones ácidos reaccionando, por lo tanto, como una base según la ecuación general siguiente, en la que se obtiene un haluro de alquilo como producto: H2 R - OH + H - X → R - X + O

Solubilidad :
Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2-propanol.
alcohol-alcohol
alcohol-agua
A partir de 4 carbonos en la cadena de un alcohol, su solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en comparación con la porción hidrocarburo. A partir del hexanol son solubles solamente en solventes orgánicos.
(hexanol )
(1-propanol)
Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones
Deshidratación de alcoholes
La deshidratación de alcoholes es el proceso químico que consiste en la conversión de un alcohol en un alqueno por proceso de eliminación. Para realizar este procedimiento se utiliza un ácido mineral para extraer el grupo hidroxilo (OH) desde el alcohol, generando una carga positiva en el carbono del cual fue extraído el OH el cual tiene una interacción eléctrica con los electrones más cercanos (por defecto, electrones de un hidrógeno en el caso de no tener otro sustituyente) que forman un doble enlace en remplazo.
Por esto, la deshidratación de alcoholes útil, puesto que fácilmente convierte a un alcohol en un alqueno.
Un ejemplo simple es la síntesis del ciclohexeno por deshidratación del ciclohexanol. Se puede ver la acción del ácido (H2SO4) ácido sulfúrico el cual quita el grupo hidroxilo del alcohol, generando el doble enlace y agua.
2 R -CH2OH ----------------) R - CH2 - O - CH2 - R'
R-R-OH ------------) R=R + H2O
DESHIDROGENACION:
Los alcoholes primarios y secundarios cuando se calientan en contacto con ciertos catalizadores, pierden átomos de hidrógeno para formar aldehídos o cetonas. Si esta deshidrogenación se realiza en presencia de aire (O) el hidrógeno sobrante se combina con el oxígeno para dar agua.
USOS
EL METANOL: Es muy toxico, su ingestión puede causar ceguera y hasta la muerte. Es un combustible de alto rendimiento por lo que se lo usa como combustible de autos de carreras.Pero como combustible es menos conocido que el etanol debido a sus altos costos.
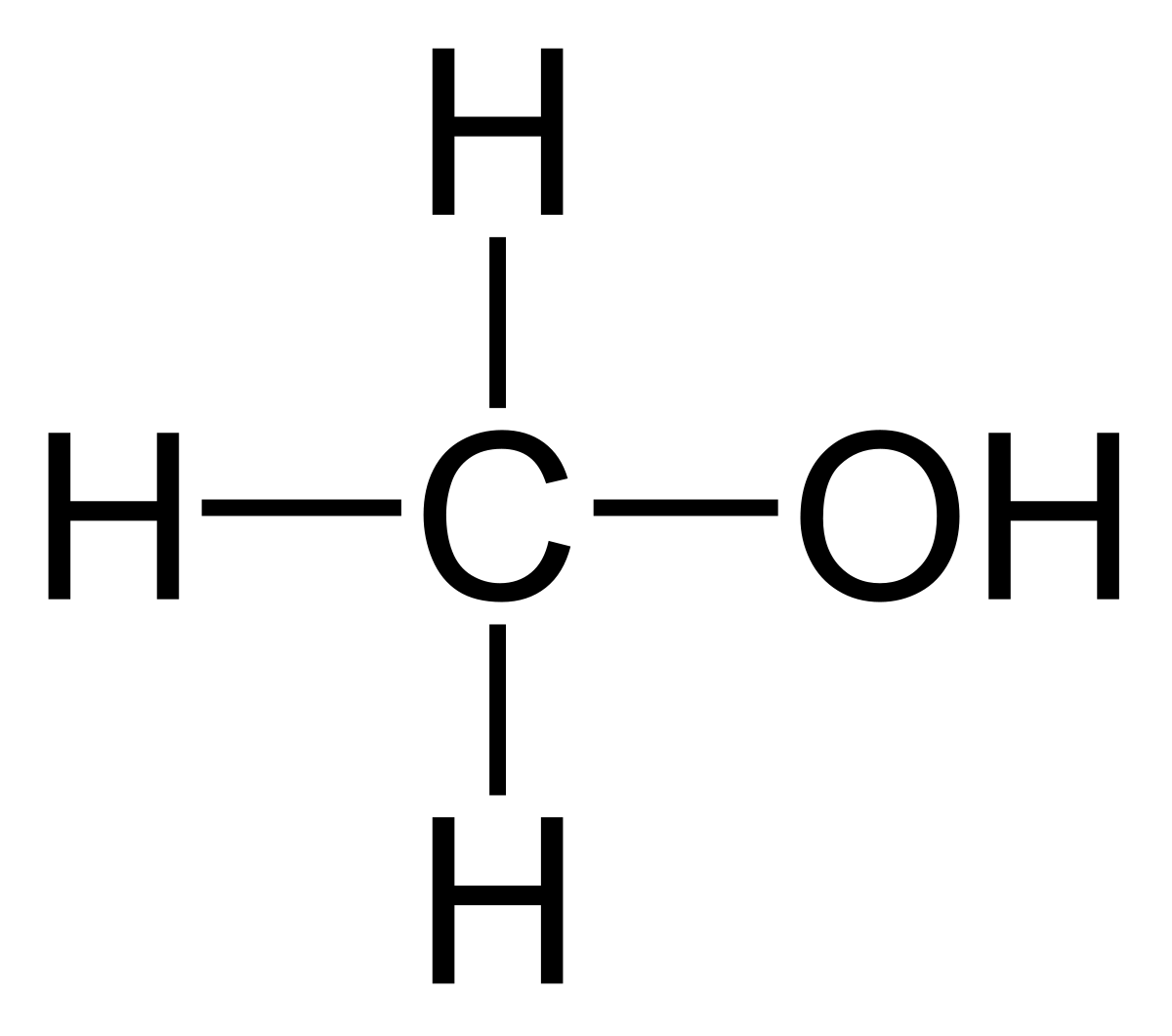
EL ETANOL: Es un líquido muy volátil y constituye la materia prima de numerosas industrias de licores,perfumes,cosmèticos y jarabes .También se usa como combustible y desinfectante .
EL PROPANOL: Se utiliza como un antiséptico aún más eficaz que el alcohol etílico; su uso mas común es en forma de quita esmalte o removedor .Disolvente para lacas, resinas, revestimientos y ceras. También para la fabricación de líquido de frenos, ácido propiónico y plastificadores.
PRINCIPALES DIFERENCIAS ENTRE FENOLES Y ALCOHOLES
➩Por oxidación los fenoles forman productos coloreados y complejos de composición indefinida.
➩Los alcoholes oxidados suavemente forman aldehídos y cetonas
➩Los fenoles reaccionan con el HNO3 dando derivados nitrados; en cambio los alcoholes forman esteres.
ACTIVIDADES
ALCOHOLES
FENOLES
VÍDEO DE FENOLES Y ALCOHOLES
WEB-GRAFÍA