TABLA PERIÓDICA
LAURA SOFÍA FLOR TRIANA
DIANA FERNANDA JARAMILLO
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
QUÍMICA
IBAGUÉ TOLIMA
11-2
2019
INTRODUCCIÓN
OBJETIVO
MARCO TEÓRICO
GRUPO IV A DE LA TABLA PERIÓDICA.

INTRODUCCIÓN
La tabla periódica de los elementos es una parte fundamental de la química, debido a que es un sistema de clasificación y organización para los diferentes elementos que en esta se pueden distinguir. por lo tanto a través del siguiente trabajo podremos identificar las funciones de los VIII grupos de los cuales se hará mención de los grupos IV, V, VI, y VII.
La tabla periódica se dividen en los metales y no metales, por consiguiente se enuncian los no metales, metales, algunos metaloides y otro no metales. Cuando nos referimos a los no metales son aquellos que poseen entre cinco y siete electrones en un ultima órbita, son malos conductores del calor y la electricidad, no poseen brillo, no son maleables ni dúctiles y, en estado sólido, son frágiles; los metales son elementos químicos que generalmente contienen entre uno y tres electrones en la última órbita, que pueden ceder con facilidad, lo que los convierte en conductores del calor y la electricidad. y los metaloides Son elementos que generalmente tienen cuatro electrones en su última órbita, por lo que poseen propiedades intermedias entre los metales y los no metales.
OBJETIVO
Comprender, reforzar y afianzar los conocimientos adquiridos identificando las falencias de las temáticas y poder superar esos obstáculos mediante los ejercicios y teorías que verán a continuación, por lo tanto este trabajo va con el fin de requerir y facilitar el conocimiento necesario para tener buen uso de cada temática y así mismo a la hora de interactuar con ellas se haga de una correcta y eficaz forma.
OBJETIVOS GENERALES
OBJETIVOS GENERALES
- Conocer directamente cada elemento
- Aprender las diferentes propiedades y reacciones que tienen los elementos
- Historia de los elementos
- Clasificar un elemento según su tipo
- Conocer la clasificación de cada elemento
CLASIFICACIÓN DE LOS ELEMENTOS
Grupo IV
- Carbono: otros no metales
- Silicio: metaloide
- Germanio: metaloide
- Estaño: metal
- Plomo: metal
GRUPO V
- Nitrógeno: otros no metales
- Fósforo: otros no metales
- Arsénico: metaloide
- Antimónio: metaloide
- Bismuto: metal
GRUPO VI
- Oxígeno: otros no metales
- Azufre: otros no metales
- Selenio: otros no metales
- Telurio: metaloide
- Polonio: metal
GRUPO VII
- Fluor: otros no metales
- Cloro: otros no metales
- Bromo: otros no metales
- Yodo: otros no metales
- Astato: metaloide
MARCO TEÓRICO
GRUPO IV A DE LA TABLA PERIÓDICA.
También conocido como grupo 14, grupo del carbono o de los carbonoideos, está formado por los siguientes elementos: carbono (C), silicio (Si), germanio (Ge), estaño (Sn) y plomo (Pb).
La mayoría de los elementos de este grupo son muy conocidos y difundidos, especialmente el carbono, elemento fundamental de la química orgánica. A su vez, el silicio es uno de los elementos más abundantes en la corteza terrestre (28%), y de gran importancia en la sociedad a partir del siglo XX, ya que es el elemento principal de los circuitos integrados.
Los elementos de este grupo forman una gran parte de la corteza terrestre, estos solo podemos encontrarlos de forma natural en forma de óxidos y también en forma de sulfuros. Los elementos de este grupo presenta diferentes estados de oxidación que son +2 y +4, los compuestos orgánicos presentan variedad en su oxidación. Mientras que los óxidos de carbono y silicio son ácidos, los del estaño y plomo son anfóteros, el plomo es un elemento tóxico.
Los elementos de este grupo forman una gran parte de la corteza terrestre, estos solo podemos encontrarlos de forma natural en forma de óxidos y también en forma de sulfuros. Los elementos de este grupo presenta diferentes estados de oxidación que son +2 y +4, los compuestos orgánicos presentan variedad en su oxidación. Mientras que los óxidos de carbono y silicio son ácidos, los del estaño y plomo son anfóteros, el plomo es un elemento tóxico.

Al bajar en el grupo, estos elementos van teniendo características cada vez más metálicas: el carbono es un no metal, el silicio y el germanio son metaloides, y el estaño y el plomo son metales.
La configuración electrónica de todos los elementos de este grupo termina en ns2,p2, debido a que al estar en el grupo 4 poseen en su capa de valencia el orbital s completo y llegan a 2 electrones en el orbital p ya que son el segundo grupo de dicho bloque (p).
CARBONO
El carbono hace parte de los no metales es único en la química porque forma un número de compuestos mayor que la suma total de todos los otros elementos combinados. La gran cantidad de compuestos de carbono es debido a la capacidad de formar fuertes enlaces entre átomos de carbono, ya sea en cadenas abiertas o cerradas, o mediante enlaces simples, dobles o triples.
El carbono elemental existe en dos formas alotrópicas cristalinas bien definidas: diamante y grafito. Otras formas con poca cristalinidad son carbón vegetal, coque y negro de humo. El carbono químicamente puro se prepara por descomposición térmica del azúcar (sacarosa) en ausencia de aire. Las propiedades físicas y químicas del carbono dependen de la estructura cristalina del elemento. A temperaturas elevadas se combina con el oxígeno para formar monóxido o dióxido de carbono.
Es el pilar básico de la química orgánica y forma parte de todos los seres vivos.

INFORMACIÓN GENERAL
- Es un sólido a temperatura ambiente
- Es el pilar básico de la química orgánica
- Se conocen cerca de 16 millones de compuestos de Carbono
- Forma parte de todos los seres vivos conocidos
- Forma el 0.2% de la corteza terrestre
- Símbolo: C
- Número atómico (Z): 6
- Serie química: No metales
- Grupo IV A o 14
- Periodo: 2
- Bloque: P
APLICACIONES
- El principal uso industrial es como el componente de hidrocarburos, especialmente los combustibles fósiles (petróleo y gas natural)
- Del petróleo se obtiene gasolina, queroseno y aceites, siendo además la materia prima empleada en la obtención del plástico


(PETRÓLEO) (GAS NATURAL)
- Las pastillas de Carbón se emplean en medicina para absorber las toxinas del sistema digestivo y como remedio de la flatulencia.
- El carbón activado se emplea en sistemas de filtrado y purificación de agua
- El carbón amorfo ("hollín") se añade a la goma para mejorar sus propiedades mecánicas. Además se emplea en la formación de electrodos (ej. de las baterías)


(BATERÍA) (PASTILLAS DE CARBÓN)
ROL DEL CARBONO
El rol del carbono en la estructura orgánica es proporcional el esqueleto de la molécula, éste determina el tamaño y la forma de la molécula en el tridimensional. También es capaz de formar una amplia variedad de compuestos diferentes y las diferentes formas en que se puede enlazar consigo mismo, como con otros elementos (H, O y N).
- Los enlaces simples entre átomos idénticos C—C y H—H son relativamente débiles.
- Los enlaces C—H son en promedio más fuertes.
Los enlaces simples C—C y C—H muestran baja tendencia a participar en reacciones químicas, en cambio C—O y C—N que son enlaces más fuertes sufren una variedad de reacciones químicas, esto ocurre por la presencia de pares de electrones no compartidos sobre los átomos de N y O lo que hace que estos átomos sean más susceptibles de ser atacados por átomos deficientes de electrones.
El carbono cuando esta unido tetrahédricamente por cuatro enlaces simples a otros cuatro carbonos o hidrógenos, no tiene pares de electrones no compartidos y por ello no es susceptible de ataque por átomos deficientes de electrones.

ENLACES QUE FORMAN EL CARBONO
- Cada electrón del último nivel se une con un electrón del último nivel de otro átomo. En el segundo dibujo cada una de estas uniones o enlaces está representada por líneas. Cada átomo de carbono al unirse necesita completar 4 enlaces.


Estructura de lewis de metano. Fórmula desarrollada del metano.
- La serie de compuestos más sencillos que forma el carbono, se denomina alcanos, pertenece a una familia de compuestos llamados hidrocarburos de cadena lineal, ya que se encuentran formados principalmente por carbono e hidrógeno.
ESTRUCTURA
- Los compuestos orgánicos que contienen solo carbón e hidrogeno reciben el nombre de hidrocarburos. Se les puede dividir en dos clases principales: hidrocarburos alifáticos y aromáticos. Estas dos clases principales se puede dividir en familias, cada una de las cuales presenta propiedades características:

SILICIO
El silicio forma parte de los elementos denominados metaloides. Este tipo de elementos tienen propiedades intermedias entre metales y no metales. En cuanto a su conductividad eléctrica, este tipo de materiales al que pertenece el silicio, son semiconductores. En su estado natural es un elemento solido no magnético, su número atómico es el 14. Es el segundo elemento más abundante en la corteza terrestre y es muy importante más que todo para las industrias.

 Jons Berzelius
Jons Berzelius
CARACTERÍSTICAS GENERALES

HISTORIA
Es evidente que la primera herramienta empleada por el hombre primitivo fue el pedernal; en latín SÍLEX-SILICIS. Acompaña al hombre en su evolución y civilización. Manipulada por él va a moldear su mano diferenciándola de la de los primates, así la presión selectiva derivada de su uso favorecerá la formación de un pulgar grande, y de un área cortical capaz de recibir las sensaciones provenientes de aquél, controlando su actividad. De esta forma el pulgar humano mucho más sensible, fuerte y hábil, es muy diferente del del simio. Una vez que el sílex fue reemplazado por el metal en funciones bélicas y como herramienta, sigue acompañándolo en las civilizaciones primitivas de Egipto y Babilonia, a través del vidrio, que ya se preparaba 3000 años antes de Cristo con arena, natron y cal.
 Jons Berzelius
Jons BerzeliusCARACTERÍSTICAS GENERALES
- Símbolo: Si
- Grupo: 14
- Número atómico: 14
- Masa atómica: 28,0855
- Punto de fusión: 1410,0 ° C (K 1683,15, 2570,0 ° F)
- Punto de ebullición: 2355,0 ° C (2.628,15 K, 4271,0 ° F)
- Número de protones/Electrones: 14
- Número de neutrones: 14
- Clasificación: Metaloide
- Densidad: 2,329 g/cm 3
- Color: gris
- Estructura cristalina: octaédrica
- Año del descubrimiento: 1823
- Descubridor: Jons Berzelius
- Usos: vidrio, semiconductores
- Obtención: Encontrado en arcilla, granito, cuarzo, arena
Octaédrica Semiconductores
PROPIEDADES FÍSICAS
- Presenta un color grisáceo.
- El silicio es un metaloide, un elemento con propiedades intermedias entre los metales y los no metales.
- Es sólido a temperatura ambiente.
- Este elemento existe en dos formas alotrópicas: una de ellas es en forma de cristales, de color negro grisáceo. La otra forma alotrópica no tiene una estructura cristalina y se la encuentra como un polvo color castaño.
- Es un elemento semiconductor de la electricidad y del calor.
- En su forma cristalina es muy duro y poco soluble.
- Presenta un leve brillo metálico.
- No es tóxico.


Cristales color negro grisáceo Forma alotrópica
PROPIEDADES QUÍMICAS
- El silicio es un elemento relativamente inerte y resistente a los ácidos.
- El agua, vapor y la mayoría de los ácidos tienen muy poco efecto sobre este elemento.
- No reacciona con el oxígeno en estado sólido.
- En estado fundido (derretido) este reacciona con el oxígeno, nitrógeno, azufre, fósforo y otros elementos.
- Es muy útil en aleaciones.
 (Inerte)
(Inerte)
GERMANIO
Elemento químico de número atómico 32, masa atómica 72,59 y símbolo Ge ; es un elemento semimetálico cristalino de color blanco grisáceo, duro, muy resistente a los ácidos y a las bases, que se encuentra en pequeñas cantidades en yacimientos de plata, cobre y cinc; se utiliza en la fabricación de transistores y otros dispositivos electrónicos. Hace parte de los metaloides.

HISTORIA
Las propiedades del germanio (del latín Germania, Alemania) fueron predichas en 1871 por Mendeleyev en función de su posición en la tabla periódica, elemento al que llamó eka-silicio. El alemán Clemens Winkler demostró en 1886 la existencia de este elemento, descubrimiento que sirvió para confirmar la validez de la tabla periódica, habida cuenta de las similitudes entre las propiedades predichas y las observadas:
 (Clemens Winkler)
(Clemens Winkler)Tabla de propiedades y observaciones
| Propiedad | Ekasilicio | Germanio |
|---|---|---|
| (Predichas, 1871) | (Observadas, 1886) | |
| Masa atómica | 72 | 72,59 |
| Densidad (g/cm3) | 5,5 | 5,35 |
| Calor específico (kJ/kg·K) | 0,31 | 0,32 |
| Punto de fusión (°C) | alto | 960 |
| Fórmula del óxido | RO2 | GeO2 |
| Fórmula del cloruro | RCl4 | GeCl4 |
| Densidad del óxido (g/cm3) | 4,7 | 4,7 |
| Punto de ebullición del cloruro (°C) | 100 | 86 |
| Color | gris | gris |
CARACTERÍSTICAS GENERALES
- Germanio Símbolo químico: Ge
- Número atómico 32
- Grupo: 14 Periodo 4
- Aspecto blanco grisáceo
- Bloque p
- Densidad 5323 kg/m3
- Masa atómica 72.64
- Electrones por capa 2, 8, 18, 4
- Estructura cristalina cúbica centrada en las caras
 (Estructura cristalina cúbica)
(Estructura cristalina cúbica)
ESTAÑO
El estaño es un elemento químico de símbolo Sn (del latín stannum) y número atómico 50. Está situado en el grupo 14 de la tabla periódica de los elementos. Se conocen 10 isótopos estables. Su principal mena es la casiterita. Hace parte de los metales del bloque p.

HISTORIA
Este elemento fue descubierto en 1854 por Julius Pelegrin. El estaño se conoce desde la antigüedad y ya se menciona en el Viejo Testamento. En Mesopotamia ya se hacían armas de bronce (aleación de cobre y estaño).
El uso del estaño comenzó en el Cercano Oriente y los Balcanes alrededor del 2000 a. C., utilizándose en aleación con el cobre para producir un nuevo metal, el bronce, dando así origen a la denominada Edad de Bronce. La importancia del nuevo metal, con el que se fabricaban armas y herramientas más eficaces que las de piedra o de hueso habidas hasta entonces, originó durante toda la Antigüedad un intenso comercio a largas distancias con las zonas donde existían yacimientos de estaño.

CARACTERÍSTICAS
Es un metal blanco, maleable, que se oxida fácilmente, a temperatura ambiente, cambiando de color a un gris más opaco, y es resistente a la corrosión. Se encuentra en muchas aleaciones y se usa para recubrir otros metales protegiéndolos de la corrosión. Al doblar una barra de este metal se produce un sonido característico llamado grito del estaño, producido por la fricción de los cristales que la componen. Una de sus características más llamativas es que bajo determinadas condiciones sufre la peste del estaño. Por debajo de los -18°C empieza a descomponerse y a convertirse en un polvo gris; a este proceso se lo conoce como peste del estaño. El estaño puro tiene dos variantes alotrópicas: el estaño gris, polvo no metálico, semiconductor, de estructura cúbica y estable a temperaturas inferiores a 13,2 °C, que es muy frágil y tiene un peso específico más bajo que el blanco. El estaño blanco, el normal, metálico, conductor eléctrico, de estructura tetragonal y estable a temperaturas por encima de 13,2 °C.

Estaño: β (izquierda) y α (derecha).
Usos
- Se usa como protector del oro, del acero y de diversos metales usados en la fabricación de latas de conserva.
- También se usa para disminuir la fragilidad del vidrio.
- Los compuestos de estaño se usan para fungicidas, tintes, dentífricos y pigmentos.
- Se usa para realizar bronce, aleación de estaño y cobre.
- Se usa para la soldadura blanda, aleado con plomo.
- Se usa en aleación con plomo para fabricar la lámina de los tubos de los órganos musicales.
- Tiene utilidad en etiquetas.
- Recubrimiento de acero.
 (acero)
(acero)
OBTENCIÓN
El estaño se obtiene del mineral casiterita donde se presenta como óxido (óxido de estaño (IV) o dióxido de estaño). Dicho mineral se muele y se enriquece en dióxido de estaño por flotación, después se tuesta y se calienta con coque en un horno de reverbero con lo cual se obtiene el metal.
PLOMO
El plomo es un elemento químico de la tabla periódica, cuyo símbolo es Pb, es un metal (del latín plumbum) y su número atómico es 82 según la tabla actual, ya que no formaba parte en la tabla periódica de Mendeleiev. Este químico no lo reconocía como un elemento metálico común por su gran elasticidad molecular. Cabe destacar que la elasticidad de este elemento depende de la temperatura ambiente, la cual extiende sus átomos.
El plomo es un metal pesado de densidad relativa o gravedad específica 11,4 a 16 °C, de color plateado con tono azulado, que se empaña para adquirir un color gris mate. Es flexible, inelástico y se funde con facilidad. Su fusión se produce a 327,4 °C y hierve a 1725 °C. Las valencias químicas normales son 2 y 4. Es relativamente resistente al ataque del ácido sulfúrico y del ácido clorhídrico, aunque se disuelve con lentitud en ácido nítrico y ante la presencia de bases nitrogenadas. El plomo es anfótero, ya que forma sales de plomo de los ácidos, así como sales metálicas del ácido plúmbico. Tiene la capacidad de formar muchas sales, óxidos y compuestos organometálicos.

HISTORIA
Origen del nombre: Procede del latín "plumbum"; los romanos utilizaban este nombre precisamente para designar al elemento plomo. Lo llamaban "plumbum nigrum" para distinguirlo del estaño, al que llamaban "plumbum candidum". ... Los alquimistas gastaron una gran cantidad de tiempo intentando "transmutar" el plomo en oro.
El elemento número 82 es uno de los pocos que la humanidad conoce desde hace miles de años. El plomo puro más antiguo, hallado en Turquía, fue trabajado por los fundidores de hace más de 8.000 años.

CARACTERÍSTICAS GENERALES
- Los compuestos de plomo más utilizados en la industria son los óxidos de plomo, el tetraetilo de plomo y los silicatos de plomo.
- El plomo forma aleaciones con muchos metales, y, en general, se emplea en esta forma en la mayor parte de sus aplicaciones.
- Es un metal pesado y tóxico, y la intoxicación por plomo se denomina como saturnismo o plumbosis.


Oxido de plomo
GRUPO V A DE LA TABLA PERIÓDICA
Los elementos que componen a la familia del nitrógeno o nitrogenoides están compuestos por los elementos químicos del grupo 15 que son:
- Nitrógeno (N)
- Fósforo (P)
- Arsénico (As)
- Antimonio (Sb)
- Bismuto (Bi)
- Moscovium (MC)
El nitrógeno es un gas que forma el 78% del aire. Comercialmente, del nitrógeno gaseoso (N2) se produce amoniaco, que es un componente común de fertilizantes y limpiadores caseros.

Debido a su configuración electrónica, estos elementos no tienden a formar compuestos iónicos, más bien forman enlaces covalentes.
El carácter metálico aumenta considerablemente conforme se desciende en el grupo, siendo el nitrógeno y el fósforo no-metales, el arsénico y el antimonio semimetales y el bismuto un metal.
(El grupo del nitrógeno está compuesto por los elementos químicos del grupo 15 de la tabla periódica)

NITRÓGENO
Elemento químico, símbolo N,hace parte de los no metales (nitrógeno diatómico o molecular) En ocasiones es llamado ázoe (antiguamente se usó también Az como símbolo del nitrógeno). , su número atómico 7, peso atómico 14.0067; es un gas en condiciones normales es decir, un gas incoloro y su formula molecuar N2.
El nitrógeno molecular es el principal constituyente de la atmósfera ( 78% por volumen de aire seco). Esta concentración es resultado del balance entre la fijación del nitrógeno atmosférico por acción bacteriana, eléctrica (relámpagos) y química (industrial) y su liberación a través de la descomposición de materias orgánicas por bacterias o por combustión. En estado combinado, el nitrógeno se presenta en diversas formas. Es constituyente de todas las proteínas (vegetales y animales), así como también de muchos materiales orgánicos. Su principal fuente mineral es el nitrato de sodio.

COMPOSICIÓN QUÍMICA
- Peso atómico: 14,0067
- Número atómico: 7
- Símbolo: N
- Punto de fusión: -210º C
- Punto de ebullición: -195,79º C
- Densidad: 1,25046 por litro.
ESTRUCTURA
- El nitrógeno se compone de dos tipos de isótopos: N14 y N15. Además se pueden encontrar otros tipos de isótopos de origen radiactivo como el N12, N13, N16 y N17.
- en estado líquido o sólido es preciso manejarlo con especial cuidado.


Estado gaseoso o Estado líquido
ESTADOS DEL NITRÓGENO
- En la naturaleza el nitrógeno se encuentra en estado gaseoso. No obstante, el hombre ha podido trasformar este estado en líquido y sólido
- Aunque sus usos más notables son en estado líquido, es importante remarcar que el estado líquido del nitrógeno debe utilizarse solo para fines específicos y teniendo en cuenta las precauciones adecuadas.
- Al ser su temperatura muy baja, puede dañar la piel y generarle quemaduras frías.

PROPIEDADES
- El calor de Disociación de las moléculas de Nitrógeno [N2] es mayor que el de cualesquiera otras moléculas diatómicas.
- En su molécula de dos átomos, los tres electrones de la capa final están ligados, los unos con los del otro. Esto genera un enlace triple muy difícil de romper.
- El Nitrógeno es uno de los elementos más inactivos, con excepción de los Gases Nobles del Grupo VIIIA.
- Cuando se calienta a elevada temperatura, se combina con metales, formando Nitruros; de este modo, se obtienen fácilmente Nitruro de Litio Li3N, Nitruro de Calcio Ca3N2, Nitruro de Magnesio Mg3N2 y Nitruro de Boro BN.
- Reacciona con los No Metales, como Oxigeno e Hidrógneo, y con Compuestos tales como el Carburo de Calcio CaC2, formando con este último Cianuro de Calcio Ca(CN)2.
ENLACES
Un enlace carbono-nitrógeno es un enlace covalente entre carbono y nitrógeno y uno de los más abundantes en la química orgánica y la bioquímica.
APLICACIÓN
La aplicación comercial más importante del nitrógeno diatómico es la obtención de amoníaco por el proceso de Haber. El amoníaco se emplea con posterioridad en la fabricación de fertilizantes y ácido nítrico.
Las sales del ácido nítrico incluyen importantes compuestos como el nitrato de potasio (nitro o salitre empleado en la fabricación de pólvora) y el nitrato de amonio fertilizante.
Los compuestos orgánicos de nitrógeno como la nitroglicerina y el trinitrotolueno son a menudo explosivos. La hidracina y sus derivados se usan como combustible en cohetes.
El ciclo de este elemento es más complejo que el del carbono, dado que está presente en la atmósfera no solo como N2 (78 %) sino también en una gran diversidad de compuestos. Se puede encontrar principalmente como N2O, NO y NO2, los llamados NOx. También forma otras combinaciones con oxígeno tales como N2O3 y N2O5 (anhídridos), "precursores" de los ácidos nitroso y nítrico. Con hidrógeno forma amoníaco (NH3), compuesto gaseoso en condiciones normales.
Al ser un gas poco reactivo, el nitrógeno se emplea industrialmente para crear atmósferas protectoras y como gas criogénico para obtener temperaturas del orden de 78K de forma sencilla y económica. Inclusive se utiliza para inflar los neumáticos en los trenes de aterrizaje de los aviones, evitando condensación de agua a grandes alturas o su combustión al aterrizar.
 (Nitrato de potasio)
(Nitrato de potasio)  (Nitrato de amonio)
(Nitrato de amonio)
ORIGEN
Se considera que el nitrógeno (del latín nitrum -i, a su vez del griego νίτρον, "nitro" -nombre que históricamente se ha usado en forma vaga para referirse a diversos compuestos de sodio y de potasio que contienen nitrógeno-, y -geno, de la raíz griega γεν-, "generar"; es decir, "que genera salitre fue descubierto formalmente por Daniel Rutherford en 1772, al dar a conocer algunas de sus propiedades (lo llamó "aire flogisticado", en función de lo que observó en su experimento de ese año4). Sin embargo, por la misma época también se dedicaron a su estudio Carl Wilhelm Scheele, quien lo aisló, Henry Cavendish y Joseph Priestley.
El nitrógeno es un gas tan inerte que Antoine Lavoisier se refería a él con el nombre azote (del griego ázoe, que significa "sin vida"56 (o tal vez lo llamó así por no ser apto para respirar7). Se clasificó entre los gases permanentes, sobre todo desde que Michael Faraday no consiguió verlo líquido a 50 atmósferas (atm) y –110 °C hasta los experimentos de Raoul Pictet y Louis Paul Cailletet, quienes en 1877 consiguieron licuarlo.
Los compuestos de nitrógeno ya se conocían en la Edad Media; así, los alquimistas llamaban aqua fortis al ácido nítrico y aqua regia (agua regia) a la mezcla de ácido nítrico y ácido clorhídrico, mezcla conocida por su capacidad para disolver el oro y el platino.

COMPUESTOS
Con el hidrógeno forma el amoníaco (NH3), los nitritos (NO2), los nitratos (NO3), los ácidos nítricos (HNO3), la hidracina (N2H4) y el aziduro de hidrógeno (N3H, también conocido como azida de hidrógeno o ácido hidrazoico). El amoníaco líquido, anfótero como el agua, actúa como una base en una disolución acuosa, formando iones amonio (NH4+), y se comporta como un ácido en ausencia de agua, cediendo un protón a una base y dando lugar al anión amida (NH2). Se conocen largas cadenas y compuestos cíclicos de nitrógeno, pero son muy inestables.
Con los halógenos forma: NF3, NF2Cl, NFCl2, NCl3, NBr3.6 NH3, NI3.6 NH3, N2F4, N2F2 (cis y trans), N3F, N3Cl, N3Br y N3I.
Con el oxígeno forma varios óxidos que ya hemos nombrado: el nitroso o gas de la risa, el nítrico y el dióxido de nitrógeno. Son producto de procesos de combustión contribuyendo a la aparición de episodios contaminantes de smog fotoquímico. Otros óxidos son el trióxido de dinitrógeno (N2O3) y el pentóxido de dinitrógeno (N2O5), ambos muy inestables y explosivos.

(Amoniaco NH3) Trióxido de dinitrógeno (N2O3)
ISÓPOTOS
Existen dos isótopos estables del nitrógeno, N-14 y N-15, siendo el primero —que se produce en el ciclo carbono-nitrógeno de las estrellas— el más común sin lugar a dudas (99,634 %). De los diez isótopos que se han sintetizado, uno tiene un periodo de semidesintegración de nueve minutos (el N-13), y el resto de segundos o menos.
Las reacciones biológicas de nitrificación y desnitrificación influyen de manera determinante en la dinámica del nitrógeno en el suelo, casi siempre produciendo un enriquecimiento en N-15 del sustrato.

Los fertilizantes nitrogenados son una importante fuente de contaminación del suelo y de las aguas. Los compuestos que contienen iones de cianuro forman sales extremadamente tóxicas y son mortales para numerosos animales, entre ellos los mamíferos.
Efectos del nitrógeno sobre la salud
Las moléculas de nitrógeno, en estado natural, se encuentran principalmente en el aire. En el agua y en los suelos el nitrógeno puede ser encontrado compuesto, en forma de nitratos y nitritos.
Los humanos han cambiado radicalmente las proporciones naturales de nitratos y nitritos, mayormente debido a la aplicación de estiércoles que contienen nitrato. El nitrógeno es emitido en grandes cantidades por las industrias. A lo largo de la historia, se nota un incremento de la presencia de nitratos y nitritos en el suelo y en el agua como consecuencia de reacciones que tienen lugar en el ciclo del nitrógeno. Esto se refleja en un incremento de la concentración de nitrógeno en las fuentes utilizadas para consumo humano, y por ende también en el agua potable.
Los nitratos y nitritos son conocidos por causar varios efectos sobre la salud humana. Estos son los efectos más comunes:12
Tiene reacciones con la hemoglobina en la sangre, causando una disminución en la capacidad de transporte de oxígeno por la sangre. (nitrito)
Provoca la disminución del funcionamiento de la glándula tiroidea. (nitrato)
Ocasiona un bajo almacenamiento de la vitamina A. (nitrato)
Favorece la producción de nitrosaminas, las cuales son conocidas como una de las causas más comunes de cáncer. (nitratos y nitritos)
Desde un punto de vista metabólico, el óxido de nitrógeno (NO) es mucho más importante que el nitrógeno. En 1987, Salvador Moncada descubrió que éste era un mensajero vital del cuerpo para la relajación de los músculos, y hoy se sabe que está involucrado en el sistema cardiovascular, el sistema inmunitario, el sistema nervioso central y el sistema nervioso periférico. La enzima que produce el óxido nítrico, la óxido-nítrico sintasa, es abundante en el cerebro.

 (Cianuro)
(Cianuro)
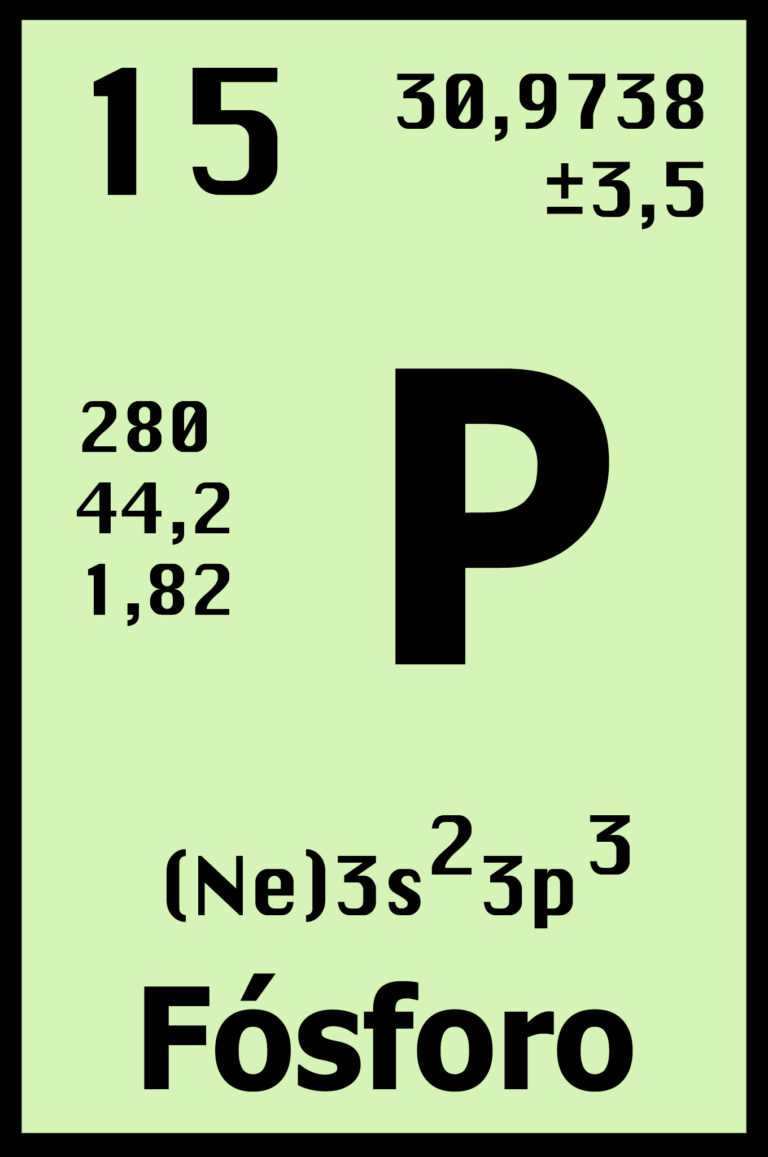
FÓSFORO
El fósforo es un elemento químico de número atómico 15 y
símbolo P. El nombre proviene del griego φώς [fos] ‘luz’ y φόρος [foros]
‘portador’. Es un no metal multivalente perteneciente al grupo del nitrógeno
(Grupo 15 (VA): nitrogenoideos) que se encuentra en la naturaleza combinado en
fosfatos inorgánicos y en organismos vivos pero nunca en estado nativo. Es muy
reactivo y se oxida espontáneamente en contacto con el oxígeno atmosférico
emitiendo luz.
El fósforo como molécula de Pi («fosfato inorgánico»),
forma parte de las moléculas de ADN y ARN, las células lo utilizan para
almacenar y transportar la energía mediante el adenosín trifosfato (ATP).
Además, la adición y eliminación de grupos fosfato a las proteínas,
fosforilación y desfosforilación, respectivamente, es el mecanismo principal
para regular la actividad de proteínas intracelulares, y de ese modo el
metabolismo de las células eucariotas tales como los espermatozoides.
Es un ciclo sedimentario, su reservativo es la corteza
terrestre. El elemento se almacena en rocas fosfatadas y a medida que estas son
erosionadas se van liberando compuestos fosfatados hacia el suelo y el agua.
Luego son absorbidos por las plantas, a través de las raíces, incorporándose a
los componentes vivos del sistema, a medida que pasan por los distintos niveles
tróficos. Una vez que los organismos (plantas o animales) mueren, se
descomponen y se libera el fósforo contenido en la materia orgánica.
 (Roca fosfatada)
(Roca fosfatada)CARACTERÍSTICAS PRINCIPALES
- El fósforo es un componente esencial de los organismos.
- Forma parte de los ácidos nucleicos (ADN y ARN).
- Forma parte de los huesos y dientes de los animales.
- En las plantas en una porción de 0,2 % y en los animales hasta el 1 % de su masa es fósforo.
- El fósforo común es un sólido.
- De color blanco, pero puro es incoloro.
- Un característico olor desagradable.
- Es un no metal.
- Emite luz por fosforescencia.

HISTORIA
El fósforo —del latín phosphŏrus, y éste del griego
φωσφόρος, portador de luz— antiguo nombre del planeta Venus, fue descubierto
por el alquimista alemán Hennig Brand en 1669 en Hamburgo al destilar una
mezcla de orina y arena (utilizó 50 cubos) mientras buscaba la piedra
filosofal; al evaporar la urea obtuvo un material blanco que brillaba en la
oscuridad y ardía con una llama brillante; desde entonces, las sustancias que
brillan en la oscuridad sin emitir calor se las llama fosforescentes. Brand
mantuvo su descubrimiento en secreto pero otro alquimista alemán, Kunckel, lo
redescubrió en 1677 y enseñó a Boyle la forma de producirlo y aplicarlo.

ABUNDANCIA Y OBTENCIÓN
Debido a su reactividad, el fósforo no se encuentra
nativo en la naturaleza, pero forma parte de numerosos minerales. La apatita es
una importante fuente de fósforo, existiendo importantes yacimientos en
Marruecos, Rusia, Estados Unidos y otros países.
La forma alotrópica blanca se puede obtener por distintos
procedimientos; en uno de ellos, el fosfato tricálcico, obtenido de las rocas,
se calienta en un horno a 1450 °C en presencia de sílice y carbono reduciendo
el fósforo que se libera en forma de vapor.

(Fosfato tricálcio)
PRECAUCIONES
El fósforo blanco es extremadamente venenoso —una dosis
de 50 mg puede ser fatal— y muy inflamable por lo que se debe almacenar
sumergido en aceite o agua para evitar su contacto con el oxígeno. El contacto
con el mismo provoca combustión inmediata y violenta. Provoca quemaduras si
entra en contacto con la piel. La exposición continua al fósforo provoca la
necrosis de la mandíbula.
El fósforo rojo no se inflama espontáneamente en
presencia de aire y no es tóxico, pero debe manejarse con precaución ya que
puede producirse la transformación en fósforo blanco y la emisión de vapores
tóxicos al calentarse.


(Fosforo rojo)
ARSÉNICO
El arsénico es un elemento químico de la tabla periódica
que pertenece al grupo de los metaloides, también llamados semimetales, se
puede encontrar de diversas formas, aunque raramente se encuentra en estado
sólido. Se conoce desde la antigüedad y se reconoce como extremadamente tóxico.
A presión atmosférica el arsénico sublima a 613 °C.
Es un elemento esencial para la vida y su deficiencia
puede dar lugar a diversas complicaciones, sin embargo, no se conoce con
precisión, la función biológica.123 La ingesta diaria de 12 a 15 μg puede
consumirse sin problemas en la dieta diaria de carnes, pescados, vegetales y
cereales, siendo los peces y crustáceos los que más contenido de arsénico
presentan.
El arsénico (del persa zarnikh, ‘oropimente amarillo’ o
bien del griego arsenikón, ‘masculino’) es un elemento químico de la tabla
periódica cuyo símbolo es As y el número atómico es 33. En la tabla periódica
de los elementos se encuentra en el quinto grupo principal. El arsénico se
presenta raramente sólido, principalmente en forma de sulfuros. Pertenece a los
metaloides, ya que muestra propiedades intermedias entre los metales de
transición y los no metales. Se conocen compuestos de arsénico desde la
antigüedad, siendo extremadamente tóxicos, aunque se emplean como componentes
en algunos medicamentos. El arsénico es usado para la fabricación de
semiconductores y como componente de semiconductores III-V como el arseniuro de
galio.
El arsénico es muy común en la atmósfera terrestre, en
rocas y suelos, en la hidrosfera y la biosfera. Es llevado al ambiente a través
de una combinación de procesos como:
- Naturales; la meteorización, actividad biológica, emisiones volcánicas
- Antropogénicos; la actividad minera, uso de combustibles fósiles, uso de pesticidas, herbicidas, etc.

 (arseniuro de galio.)
(arseniuro de galio.)
HISTORIA
Símbolo alquímico del arsénico. El primer hombre en descubrirlo fue el químico alemán Alberto Magno en el año de 1250. Su nombre procede de las palabras griegas arsenikos que quiere decir varonil, macho o de la palabra arsenikon que era el nombre griego del auripigmento, mineral que contiene arsénico.
El arsénico (del griego άρσενιχόν, oropimente) se conoce desde tiempos remotos, lo mismo que algunos de sus compuestos, especialmente los sulfuros. Dioscórides y Plinio el Viejo (griegos siglo I) conocían las propiedades del oropimente y el rejalgar y Celso Aureliano (romano siglo I), Galeno (siglo II) sabían de sus efectos irritantes, tóxicos, corrosivos y parasiticidas y observaron sus virtudes contra las toses pertinaces, afecciones de la voz y las disneas.
Los médicos árabes usaron también los compuestos de arsénico en fumigaciones, píldoras y pociones además de en aplicaciones externas. Durante la Edad Media los compuestos arsenicales cayeron en el olvido quedando relegados a los curanderos que los prescribían contra la escrófula y el hidrocele.
Roger Bacon y Alberto Magno se detuvieron en su estudio —se cree que este último fue el primero en aislar el elemento en el año 1250— y Paracelso hizo de él una panacea. Leonardo da Vinci lo utilizó mediante endoterapia aplicándolo a los manzanos para controlar a los ladrones de frutas.
El primero que lo estudió con detalle fue Brandt en 1633 y Schroeder lo obtuvo en 1649 por la acción del carbón sobre el ácido arsénico. A Berzeliuss se deben las primeras investigaciones acerca de la composición de los compuestos del arsénico.
En el siglo XVIII los arsenicales consiguieron un puesto de primer orden en la terapéutica hasta que fueron sustituidos por las sulfamidas y los antibióticos.

CARACTERÍSTICAS PRINCIPALES
- Se puede presentar en tres formas sólidas distintas.
- El arsénico gris es el más común. Tiene un brillo metálico y es capaz de conducir la electricidad.
- El amarillo es metaestable, es un conductor eléctrico deficiente y no tiene ningún tipo de brillo metálico. Se prepara enfriando el vapor de arsénico gris en aire líquido.
- El negro es vidrioso, quebradizo y un conductor eléctrico deficiente.
- Nombre, símbolo, número atómico son respectivamente: Arsénico, As, 33.
- Su masa atómica es de 74,92160 u.


(Arsénico Gris) (Arsénico negro)

ANTIMONIO
El antimonio es un elemento químico que forma parte del grupo de los metaloides de número atómico 51 situado en el grupo 15 de la tabla periódica de los elementos. Su nombre y abreviatura (Sb) procede de estibio, término hoy ya en desuso, que a su vez procede del latín stibium ("Banco de arena gris brillante"), de donde se deriva la palabra estibio note su principal mena es la estibina.
Este elemento semimetálico tiene cuatro formas alotrópicas. En su forma estable es un metal blanco azulado. El antimonio negro y el amarillo son formas no metálicas inestables. Principalmente se emplea en aleaciones metálicas y algunos de sus compuestos para dar resistencia contra el fuego, en pinturas, cerámicas, esmaltes, vulcanización del caucho y fuegos artificiales.


HISTORIA
Nadie nace sabiéndolo todo. La humanidad, como conjunto,
no es una excepción: desde que empezamos a explorar nuestro entorno en busca de
sustancias que nos hicieran la vida más fácil, hemos aprendido a base de prueba
y error que algunas de esas cosas no son tan buenas como habíamos pensado en un
primer momento.
Estudios arqueológicos e históricos indican que el
antimonio y sus sulfuros han sido usados por los humanos al menos durante los
últimos 6 milenios. En la antigüedad la antimonita o estibina, Sb2S3, la forma
más común de sulfuro de antimonio fue el principal ingrediente del “kohl”, una
pasta negra usada por los egipcios, entre otros, como maquillaje para los
ojos.23 Los babilonios conocían la forma de obtener antimonio de sus
compuestos y lo usaban como ornamento para vasijas.
El alquimista Basil Valentine (1565-1624), presentado a
veces como el descubridor del antimonio, fue el primero en describir la
extracción de antimonio de sus compuestos en su tratado “Triumph Wagens des
Antimonij” (El carro triunfal del antimonio).
El nombre antimonio viene de una latinización de la
palabra árabe انتيمون ("al-ithmīd"), que a su vez consistía en una
arabización de la palabra latina stibium.567
Otras teorías sugieren que antimonio es un compuesto de
las palabras latinas “anti"(miedo) y “mono” (solo); lo que haría
referencia a su existencia en la naturaleza normalmente como compuesto.note
289
Tras la invención de la imprenta en el siglo XVI el
antimonio fue usado como aleante para los sellos tipográficos. Al enfriar, el
antimonio líquido tiene la propiedad excepcional de expandirse mientras se
solidifica. De este modo consigue rellenar las grietas de los moldes, por lo
que las aristas de las piezas que se obtienen son muy afiladas. Por esta razón,
se usó para hacer tipos de imprenta. En el siglo XIX su aleación con zinc
(metal inglés) fue utilizada en los cubiertos, palmatorias y candelabros.
Tras el invento del acumulador eléctrico se comprobó que
el uso de la aleación de plomo y antimonio hacía durar mucho más a los mismos.
Durante la Primera Guerra Mundial se alcanzó un máximo de producción, debido a
su uso armamentístico, ya que este semimetal aumenta mucho la dureza y la
fuerza mecánica del plomo y del estaño. Con el desarrollo de la industria
automovilística el uso del antimonio ha ido aumentando año tras año, aunque los
niveles de la Primera Guerra Mundial no se volvieron a alcanzar hasta los años
1990.


CARACTERÍSTICAS PRINCIPALES
- El símbolo con el cual es representado el antimonio es el Sb
- Está clasificado como un elemento nitrogenoide del Grupo 15 de los metaloides
- Su número Atómico es de 51
- Su masa Atómica es de 121,760
- El número de protones y electrones que tiene es de 51
- Su número de neutrones es de 71
- Su estructura electrónica es la siguiente: [Kr] 4d10 5s2 5p3
- Tiene una electronegatividad de apenas 2,05
- Su energía de ionización (kJ.mol-1) es de 834
- Su radio atómico es de 141
- Su punto de Fusión es de 630,63 C °
- El punto de Ebullición es de 1587 C °
- Tiene una densidad (kg/m3) de 6691
- Su volumen atómico (cm3/mol) es de 18,20
- Tiene una estructura cristalina y una forma romboédrica
- Es de color blanco azulado

(Número de protones)
APLICACIONES QUE SE LE DAN AL ANTIMONIO
- bacterías y acumuladores
- tipos de imprenta
- Recubrimiento de cables
- Cojinetes y rodamientos
- El antimonio se ha utilizado como un endurecedor para el plomo usado en la munición.
- Cantidades pequeñas de antimonio de gran pureza se utilizan en los DVD.
- Utilizado en medicina, por sus buenas actitudes expectorantes, eméticas y purgantes.


ABUNDANCIA Y OBTENCIÓN
El antimonio se encuentra en la naturaleza en numerosos
minerales, aunque es un elemento poco abundante. Pero es posible encontrarlo
libre, normalmente está en forma de sulfuros; la principal mena de antimonio es
la antimonita (también llamada estibina), Sb2S3.
Mediante el tostado del sulfuro de antimonio se obtiene
óxido de antimonio (III), Sb2O3, que se puede reducir con coque para la
obtención de antimonio.
2Sb2O3 + 3C → 4Sb + 3CO2
También se puede obtener por reducción directa del
sulfuro, por ejemplo con chatarra de hierro:
Sb2S3 + 3Fe → 2Sb + 3FeS

Oxido de antimonio (III)
BISMUTO
El bismuto es un elemento químico de la tabla periódica
cuyo símbolo es Bi, su número atómico es 83 y se encuentra en el grupo 15 del
sistema periódico. Ya era conocido en la antigüedad, pero hasta mediados del
siglo XVIII era confundido con el plomo, estaño y zinc.
Ocupa el lugar 73 en
abundancia entre los elementos de la corteza terrestre y es tan escaso como la plata. Los principales
depósitos están en Sudamérica, pero en Estados Unidos se obtiene principalmente
como subproducto del refinado de los minerales de cobre y plomo.

HISTORIA
Origen del nombre; De la palabra alemana
"bisemutum" que significa "materia blanca", en alusión al
color del elemento.
Obtención: Sobre el siglo XIII se confundía con el plomo
y el estaño. Claude Geoffrey demostró,
en 1753, que era diferente del plomo. Karl Scheele y Torbern Bergman
descubrieron el bismuto como elemento.
El bismuto es uno de los primeros diez metales que fueron
descubiertos, ya conocido desde la antigüedad, por lo que a ninguna persona se
le atribuye su descubrimiento. El elemento se confundió en los primeros tiempos
con el estaño y el plomo, debido a su parecido con esos elementos. Georgius
Agricola, en De Natura Fossilium (ca. 1546) afirma que el bismuto es un metal
distinto en una familia de metales que incluía al estaño y al plomo, basándose
en la observación de sus propiedades físicas.1 Los mineros en la edad de la
alquimia también dieron al bismuto el nombre de tectum argenti, o "plata
haciéndose", en el sentido de que la plata estaría todavía en proceso de
formación dentro de la Tierra.

CARACTERÍSTICAS
- El bismuto es sólido a temperatura ambiente, presentando bajo punto de fusión.
- Se caracteriza por ser un metal frágil y quebradizo, presentando una tonalidad rosácea y de coloración iridiscente
- Es el metal más diamagnético de la tabla periódica, o sea, es repelido por campos magnéticos fuertes.
- En la naturaleza, además de su forma elemental, también se encuentra en la forma de los siguientes minerales: bismutinita (Bi2S3) y bismita (Bi2O3).
- También se lo puede encontrar junto con la plata, el zinc y el plomo
 (bismutina)
(bismutina)
PRESENCIA NE COMPUESTOS ORGÁNICOS
Puede ser hallado formando uniones covalentes en ciertos
compuestos orgánicos.
(TRIMETILBISMUTANO)
STABISOL
TIOGLICOLATO DE BISMUTO
MOSCOVIO
El moscovio
(anteriormente llamado unumpentio, Uup) es un elemento sintético de la tabla
periódica cuyo símbolo es Mc y su número atómico es 115.4
Actualmente se conocen
cuatro isótopos desde 287Mc hasta 290Mc. Se prevé que el isótopo más estable
del moscovio sea el 299Mc, que contiene el número mágico de 184 neutrones. El
isótopo con mayor número de neutrones conocido hasta la fecha es el 290Mc, con
175 neutrones. Es muy inestable, con una vida media de milésimas de segundo. Su
nombre hace referencia a la provincia de Moscú, región a la que pertenece la
ciudad rusa donde se descubrió, Dubná.

HISTORIA
- Descubridor: Equipo del Instituto Nuclear de Dubna.
- Lugar de descubrimiento: Dubna, Rusia.
- Año de descubrimiento: 2004.
- Origen del nombre: Su nombre hace referencia a la provincia de Moscú, región a la que pertenece la ciudad rusa donde se descubrió, Dubna.
- Obtención: Se obtiene mediante bombardeo de americio-243 con calcio-48 para producir iones de cuatro átomos de moscovio.
El 5 de diciembre del 2016 la Unión Internacional de
Química Pura y Aplicada (IUPAC) y la Unión Internacional de Física Pura y
Aplicada (IUPAP) aprobaron su denominación junto a otros tres elementos como el
nihonio, tenesino y oganesón. Además fue agregado a la tabla periódica de los
elementos, al igual que los otros tres


GRUPO VI DE LA TABLA PERIÓDICA
El grupo de
los anfígenos o calcógenos es también llamado familia del
oxígeno y es el grupo conocido antiguamente como VI A, y actualmente el
grupo 16 (según la IUPAC) en la tabla periódica de los elementos,
formado por los siguientes elementos: oxígeno (O), azufre (S), selenio (Se), telurio (Te), polonio (Po)
y Livermorio (Lv). El nombre de anfígeno en español deriva de la propiedad
de algunos de sus elementos de formar compuestos con carácter ácido o básico.

Aunque todos ellos tienen seis electrones de
valencia (última capa s2p4), sus propiedades varían de no metálicas a metálicas
en cierto grado, conforme aumenta su número atómico. Los tres primeros elementos, el oxígeno, azufre y selenio son
no metales y los dos últimos el telurio y polonio son metaloides.
El oxígeno y
el azufre se utilizan abiertamente en la industria y el telurio y el selenio en
la fabricación de semiconductores.
Como en todos los grupos, el primer elemento, el oxígeno,
presenta un comportamiento anómalo, ya que al no tener orbitales d en la capa
de valencia, sólo puede formar dos enlaces covalentes simples o uno doble,
mientras que los restantes elementos pueden formar 2, 4 y 6 enlaces covalentes.
OXÍGENO
El oxígeno es uno de los elementos más importantes y por tal razón posee una gran cantidad de aplicaciones. Es una no metal, principalmente, es utilizado en medicina como terapia para las personas que tienen dificultad para respirar debido a alguna enfermedad como enfisema o neumonía. El oxígeno gaseoso es venenoso para las bacterias anaeróbicas que producen gangrena (muerte de tejidos orgánicos), por lo que se emplea para eliminarlos.
El envenenamiento por monóxido de carbono se trata también con oxígeno gaseoso.
El oxígeno con un alto grado de pureza se emplea en los trajes espaciales para que los astronautas puedan respirar.
De igual manera, es usado en los tanques de buceo, no obstante, se suele combinar con aire normal. Los tanques de oxígeno son también utilizados frecuentemente en aviones y submarinos en caso de emergencias. Igualmente, el oxígeno puro es usado para garantizar la combustión completa de los productos químicos. Una gran cantidad del oxígeno producido para aplicaciones comerciales se emplea para convertir el mineral de hierro en acero.

USOS
- Para el tratamiento de agua
- Cortar y soldar metales
- Obtención de polímeros de poliéster y los anticongelantes. Los polímeros se usan para fabricar plástico y telas.
- El oxígeno líquido es usado como comburente para el lanzamiento de cohetes espaciales, generalmente empleando RP-1 como combustible, en una mezcla llamada Kerolox.



(comburente)
HISTORIA
Carl Wilhelm Scheele, un químico sueco, fue el primero que lo preparó, en 1772. ... Pero a quien se considera como su descubridor es Joseph Priestley, un químico británico y ministro inglés de una iglesia en 1774, año en el que publico sus resultados sobre el descubrimiento del oxígeno.
El oxígeno se prepara en el laboratorio a partir de sales como son el clorato de potasio, el peróxido de bario y el peróxido de sodio. Los métodos industriales para la obtención de oxígeno son la electrósis del agua y la destilación fraccionada de aire líquido. En este método último, se licúa el aire dejándolo que se evapore y en el aire líquido, el nitrógeno puede hacerse más volátil y evaporándose a sí mismo, haciendo antes que quede el oxígeno en estado líquido. El oxígeno se almacena y se transporta en forma líquida o de manera gaseosa.

 Joseph Priestley
Joseph PriestleyAZUFRE
Es un elemento químico fundamental y un componente principal de los aminoácidos cisteina y metionina y, por lo tanto, indispensable para la síntesis de proteínas presentes en todos los organismos vivos. Por tal razón, muchos agricultores que cultivan alimentos orgánicos emplean azufre como un pesticida y fungicida natural es un no metal.
Pero la aplicación más destacada en el ámbito comercial de este elemento es en la obtención de ácido sulfúrico. El ácido sulfúrico es sumamente necesario para una gran cantidad de industrias. Este compuesto se emplea en la elaboración de fertilizantes, tratamiento de aguas residuales, baterías de plomo para vehículos, extracción de mineral, eliminación de óxido de hierro, producción de nylon y obtención de ácido clorhídrico.
El azufre se usa para vulcanizar caucho. La vulcanización es un proceso mediante el cual se calienta el caucho crudo en presencia de azufre, con la finalidad de tornarlo más duro y resistente al frío. El caucho vulcanizado se emplea para elaborar neumáticos para automóviles, mangueras, suelas de zapatos y discos de hockey sobre hielo.

COMPUESTOS DE AZUFRES MÁS USADOS:
- El sulfato de magnesio se emplea como laxante, en sales de baño y como un complemento de magnesio para las plantas.
- El disulfuro de carbono se usa para elaborar celofán y rayón.
- Los sulfitos se emplean para blanquear el papel y conservar la fruta.


(Celofan) (Sulfitos)
HISTORIA
El azufre (del latín sulphur, sulfŭris, vinculado con el sánscrito śulbāri) es conocido desde la Antigüedad, y ya los egipcios lo utilizaban para purificar los templos. En el Génesis (19,24), los hebreos decían que Dios (Yahvé) hizo llover sobre Sodoma y Gomorra azufre y fuego desde el cielo.
El Azufre se conoce desde tiempos inmemoriales, pero como elemento fue descubierto por Henning Brand. Un comerciante y alquimista amateur de Hamburgo (quien además descubrió el fósforo). Sin embargo fue el químico francés Antoine Lavoisier, quien a través de una serie de experimentos realizados en 1777, descubrió que el azufre es un elemento en lugar de un compuesto y fue el primero en clasificarlo como elemento químico.

Henning Brand Antoine Lavoisier
Fuente: https://www.caracteristicas.co/azufre/#ixzz5f2sMsCBv
SELENIO
El selenio es un elemento químico de la tabla periódica cuyo símbolo es Se, cuyo número atómico es 34. Pertenece a la familia de los no metales. De color gris brillante, de características parecidas a las del azufre, que se emplea en instalaciones eléctricas por ser buen conductor de la electricidad y en la fabricación de vidrio.

HISTORIA
El selenio (del griego σελήνιον,"selénion", resplandor de la Luna y por selene o artemisa la diosa griega de la luna y los animales) fue descubierto en 1817 por Jöns Jacob Berzelius. Al visitar la fábrica de ácido sulfúrico de Gripsholm observó un líquido pardo rojizo que calentado al soplete desprendía un olor fétido que se consideraba entonces característico y exclusivo del telurio —de hecho su nombre deriva de su relación con este elemento ya que telurio proviene del latín Tellus, la Tierra— resultando de sus investigaciones el descubrimiento del selenio. Más tarde, el perfeccionamiento de las técnicas de análisis permitió detectar su presencia en distintos minerales pero siempre en cantidades extraordinariamente pequeñas.

CARACTERÍSTICAS
- El selenio existe en varias formas. La forma más estable, llamada selenio hexagonal cristalino, es gris metálico.
- El selenio amorfo en su forma de polvo es color rojizo y en su forma vítrea se torna negro. El selenio cristalino monoclínico, otra forma del selenio, tiene un color rojo intenso.
- El selenio gris cristalino es eléctricamente fotoconductivo, es decir que conduce la electricidad mucho mejor en la luz en comparación a la oscuridad.
- Se lo denomina fotovoltaico, es decir que tiene la capacidad de convertir la luz en electricidad.
- Los seleniuros se forman cuando el selenio se combina con metales y oxígeno. El seleniuro de zinc (ZnSe) y el selenato de calcio (CaSeO4) son ejemplos de esto.


(sistema cristalino hexagonal) (selenio gris)
PROPIEDADES
- El selenio tiene las propiedades de un metal, combinado con las del azufre y similitudes al telurio. Tiene varias formas alotrópicas, en las que cambias las propiedades físicas y químicas.
- La forma cristalina, o metálica, tiene un estado sólido y un punto de fusión de 493° K (220° C) y un punto de ebullición de 958° K (685° C). Las formas amorfas no tienen puntos de fusión. La estructura física del selenio es larga, cadenas helicoidales denominadas cristalinas hexagonales y Se8 en anillos llamados monoclínicos cristalinos.

TELURIO
El telurio o teluro es un elemento químico cuyo símbolo es Te y su número atómico es 52. Es un metaloide que se encuentra en el grupo 16 y el periodo 5 de la Tabla periódica de los elementos.

HISTORIA
- Descubridor: Franz Joseph Muller von Reichstein.
- Lugar de descubrimiento: Rumania.
- Año de descubrimiento: 1782.
- Obtención: Fue descubierto en minerales de oro por Muller von Reichstein, inspector jefe de minas en Transilvania, en 1782. En principio se confundió con el antimonio. Fue Klaproth, en 1798, quien aisló el metal y lo llamó Telurio.
- Origen del nombre: De la palabra latina "tellus" que significa "Tierra", en honor a la diosa romana Tellus que personificaba a la Tierra en la mitología latina. Obtención: Fue descubierto en minerales de oro por Muller von Reichstein, inspector jefe de minas en Transilvania, en 1782.

ABUNDANCIA Y OBTENCIÓN
El telurio puede obtenerse combinado con oro en la calaverita, un mineral metálico relativamente poco abundante. [cita requerida]
En abril de 2017 se publicó el hallazgo del mayor yacimiento de telurio del mundo, en aguas de las Islas Canarias (España), en los montes submarinos situados dentro de las aguas canarias llamadas "las abuelas de Canarias" (Drago, Bimbache, Ico, Pelicar, Malpaso, Tortuga e Infinito y Las Abuelas). Se calcula que el yacimiento tiene un total de unas 2670 toneladas de Telurio, unas 50 000 veces más que el hallazgo más grande encontrado hasta ahora.

Barra de telurio puro
CARACTERÍSTICAS PRINCIPALES
- Su número atómico es de 52
- La masa atómica del telurio es de 127,6
- El símbolo atómico con el que lo encontramos en la tabla periódica de los elementos es el Te
- Tienen un punto de fusión de 450° C
- Su punto de ebullición es de 988° C
- Tiene una densidad de 6.24 g.cm-3
- Pertenece al periodo 5 de la tabla periódica, en el grupo 16
- Su color es plateado y blancuzco.
- Es uno de los metaloides más conocidos que existen.
- En su estado cristalizado puede llegar a ser pulverizado con mucha facilidad


(Estado: cristalizado)
POLONIO
El polonio es un elemento químico en la tabla periódica de los elementos cuyo símbolo es Po y su número atómico es 84. Se trata de un raro metal altamente radiactivo, químicamente similar al telurio y al bismuto, presente en minerales de uranio. Químicamente similar al telurio y al bismuto, presente en minerales de uranio.

HISTORIA
Este elemento fue descubierto en Sklodowska, por Pierre Curie y Marie Curie en 1898. Pero tiempo después fue nombrado Polonio en honor a la tierra nata de Marie Curie (Polonia).

El Polonio fue el primer elemento descubierto por esta pareja al intentar encontrar el origen de la radiactividad de la pechblenda. necesitaron muchas toneladas de pechblenda para así poder obtener bajas cantidades de polonio, para después separarlo mediante mediciones de radiactividad, los montones de que mas radiactividad emitían eran los que contenían polinomio. Así fue como lo fueron reuniendo hasta separarlo. Bombardeando bismuto natural (209Bi) con neutrones se obtiene el isótopo del bismuto 210Bi, el cual mediante desintegración origina el polonio.

CARACTERÍSTICAS Y PRECUACIONES
- Esta sustancia se disuelve con mucha facilidad en ácidos, pero es sólo ligeramente soluble en alcalinos.
- Está químicamente relacionado con el teluro y el bismuto. El polonio es un metal volátil, reducible al 50% tras 45 horas al aire a una temperatura de 54,8 °C (328 K).
- Ninguno de los 50 isotopos [numero estimado] de polonio es estable.
- Es extremadamente tóxico y altamente radiactivo. Se ha encontrado polonio en minerales de uranio, humo de tabaco y como contaminante.
- Todos los elementos a partir del polonio son significativamente radiactivos. Se encuentra en el grupo 16 y su número atómico es 84.
- Los tumores aparecen con un nivel de polonio 210 cinco veces más bajo que la dosis de una persona que fuma mucho.


OBTENCIÓN
Aunque es un elemento de procedencia natural, sólo está presente en los minerales de uranio natural en razón de 100 microgramos por tonelada.
En 1934 se demostró que, cuando el bismuto natural (209Bi) es bombardeado con neutrones, se crea 210Bi, que se transforma mediante una desintegración beta en Polonio-210. Se puede crear polonio en cantidades de miligramos mediante este procedimiento, utilizando flujos de neutrones grandes, como los que se encuentran en los reactores nucleares.

minerales de uranio
GRUPO VII DE LA TABLA PERIODICA
El grupo VIIA del Sistema Periódico o grupo de los Halógenos (que proviene del griego y significa formadores de sales) se caracteriza por el carácter iónico de muchos de sus compuestos, al reaccionar con metales.
La configuración electrónica externa de sus átomos nos indica que les falta un solo electrón para completar el nivel y adquirir la estructura correspondiente al gas noble que le sigue en el Sistema Periódico. Por ello, forman iones negativos con gran facilidad. Presentan una gran reactividad, siendo mayor en el flúor y disminuyendo conforme descendemos en el grupo.

Los halógenos (del griego, formador de sales) son los elementos químicos que forman el grupo 17 (XVII A, utilizado anteriormente) o grupo VII A de la tabla periódica: flúor (F), Cloro (Cl), bromo (Br), yodo (I), astato (At) y téneso (Ts).
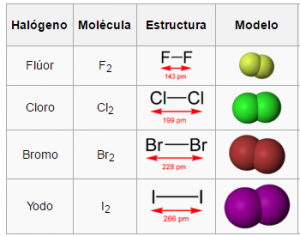
FLUOR
El fluor es un no metal, es el elemento químico de número atómico 9 situado en el grupo de los halógenos (grupo 17) de la tabla periódica de los elementos. Su símbolo es F.
Es un gas a temperatura ambiente, de color amarillo pálido, formado por moléculas diatómicas F2. Es el más electronegativo y reactivo de todos los elementos. En forma pura es altamente peligroso, causando graves quemaduras químicas al contacto con la piel.

HISTORIA
- Descubridor: Henri Moissan.
- Lugar de descubrimiento: Francia.
- Año de descubrimiento: 1886.
- Origen del nombre: De la palabra latina "fluere", que significa "fluir".
- Obtención: El flúor fue un elemento que se resistió mucho a ser aislado. Los químicos sabían dónde encontrarlo, pero resultaba muy difícil separarlo de sus compuestos por su gran reactividad química. Finalmente, fue aislado por Moissan, efectuando una electrólisis de una disolución de fluoruro potásico en ácido fluorhídrico anhidro líquido. Para albergar el gas empleó un recipiente de platino y de iridio.


MÉTODOS DE OBTENCIÓN
- Mediante electrólisis de fluoruro ácido de potasio anhidro (KF · 3HF) fundido a temperaturas entre 70 - 130 ºC.
- Como subproducto en la síntesis de ácido fosfórico y superfosfatos.
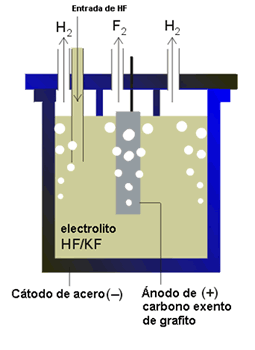 (electrolósis fluoruro)
(electrolósis fluoruro)
APLICACIONES
- Enriquecimiento del isótopo fisionable 235U, mediante formación del hexafluoruro de uranio y posterior separación por difusión gaseosa.
- Propelente de cohetes.
- El ácido fluorhídrico se emplea para: grabado de vidrio, tratamiento de la madera, semiconductores y en la fabricación de hidrocarburos fluorados.
- El hexafluoruro de azufre se utiliza como material dieléctrico.
- La criolita, Na2AlF6 se utiliza como electrólito en la metalurgia del aluminio.
- El fluoruro de calcio se introduce en alto horno y reduce la viscosidad de la escoria en la metalurgia del hierro.
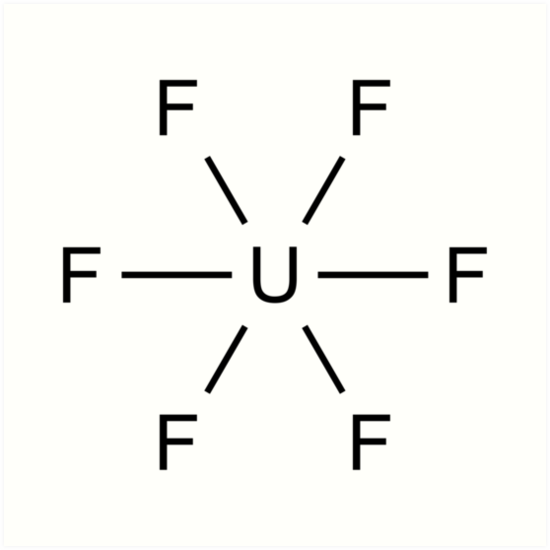 (hexafluoruro de uranio)
(hexafluoruro de uranio)
CARACTERÍSTICAS GENERALES
- Símbolo: F
- Clasificación: perteneciente al grupo de los halógenos (grupo 17)
- Número atómico: 9
- Configuración electrónica: 1s2 2s2 2p5
- Masa atómica: 18,99
- Densidad: 1,7 g/cm3
- Punto de fusión: -219,62°C
- Punto de ebullición: -188,1°C
- Número de protones/electrones: 9
- Número de neutrones: 10
- Color: verdoso
- Año de descubrimiento: 1771
- Descubridor: Sheele
- Fuentes minerales: fluorita (CaF2) y criolita (Na3AlF6).

CLORO
El cloro es un elemento químico de número atómico 17 es un no metal situado en el grupo de los halógenos (grupo VIIA) de la tabla periódica de los elementos. Su símbolo es Cl. En condiciones normales y en estado puro forma dicloro: un gas tóxico amarillo-verdoso formado por moléculas diatómicas (Cl2) unas 2,5 veces más pesado que el aire, de olor desagradable y tóxico. Es un elemento abundante en la naturaleza y se trata de un elemento químico esencial para muchas formas de vida.

HISTORIA
- Descubridor: Carl William Scheele.
- Lugar de descubrimiento: Suecia.
- Año de descubrimiento: 1774.
- Origen del nombre: De la palabra griega "chloros", que significa "verde pálido", reflejando el color del gas.
- Obtención: Scheele hizo reaccionar al mineral pirolusita (dióxido de manganeso, MnO2) con ácido clorhídrico. La reacción química produjo un gas verdoso con un olor sofocante y desagradable. Observó que blanqueaba las hojas verdes y corroía los metales. Scheele pensó que este gas contenía oxígeno. Fue Davy, en 1810, quien confirmó que el cloro era un elemento y le puso nombre.


APLICACIONES
- Potabilizar y depurar el agua para consumo humano.
- Producción de papel, colorantes ,textiles, productos derivados del petróleo, antisépticos, insecticidas, medicamentos, disolventes, pinturas, plásticos, etc.
- En grandes cantidades, el cloro es consumido, para: productos sanitarios, blanqueantes, desinfectantes y productos textiles.
- Producción de ácido clorhídrico, cloratos (usados como oxidantes, fuentes de oxígeno en fósforos en explosivos), cloroformo y tetracloruro de carbono (estas dos últimas sustancias se emplean para obtener refrigerantes, propulsores y plásticos).
- En la extracción de bromo.


CARACTERÍSTICAS/PROPIEDADES FÍSICAS Y QUÍMICAS
- Se encuentra en estado gaseoso.
- Es de color amarillo verdoso.
- Es diatómico.
- Es un gas liviano.
- Presenta solubilidad en agua.
- El cloro es un gas denso.
- El cloro es un elemento muy activo.
- Se puede combinar con todos los elementos salvo los gases nobles.
- La reacción entre el cloro y otros elementos puede ser a veces violenta. Por ejemplo, el cloro reacciona explosivamente con el hidrógeno para formar cloruro de hidrógeno.
- El cloro no se quema.
- Es un agente oxidante fuerte.
- Posee alta electronegatividad, la tercera más alta que todos los elementos reactivos.

(elemento diatómico)
BROMO
Es el único elemento no metálico líquido a temperatura y presión normales. Es muy reactivo químicamente; elemento del grupo de los halógenos, sus propiedades son intermedias entre las del cloro y las del yodo. Los estados de valencia más estables de las sales de bromo son 1- y 5+, aunque también se conocen 1+, 3+ y 7+.

HISTORIA
- Descubridor: Antoine J. Balard.
- Lugar de descubrimiento: Francia.
- Año de descubrimiento: 1826.
- Origen del nombre: De la palabra griega "brómos" que significa "fetidez", debido al fuerte y desagradable olor de este elemento, sobre todo de sus vapores.
- Obtención: El químico francés Balard, que estaba trabajando con sales precipitadas del agua de los pantanos de Montpellier, descubrió que, al añadir ciertos productos químicos, aparecía una sustancia de color pardo, irritante y de olor desagradable, se comprobó que era un nuevo elemento químico: el bromo.

MÉTODOS DE OBTENCIÓN
- Oxidación de bromuros con cloro. El bromo que se obtiene se condensa, destila y deseca.
- En el laboratorio se obtiene por acción del ácido sulfúrico sobre bromuro potásico con dióxido de manganeso como catalizador.

APLICACIONES
- El bromuro de metilo se emplea como fumigante.
- El hexabromobenceno y el hexabromociclododecano se emplean como agentes antiinflamables.
- El bromo se emplea en la fabricación de fibras artificiales.
- El bromo se usa para la desinfección de aguas de piscinas.
- Los bromuros inorgánicos (bromuro de plata) se emplean en fotografía.
YODO
El yodo o iodo es un elemento químico no metal de número atómico 53 situado en el grupo de los halógenos de la tabla periódica de los elementos. Su símbolo es I. Este elemento puede encontrarse en forma molecular como yodo diatómico. Es un oligoelemento y se emplea principalmente en medicina, fotografía y como colorante.

HISTORIA
- Descubridor: Bernard Courtois.
- Lugar de descubrimiento: Francia.
- Año de descubrimiento: 1811.
- Origen del nombre: De la palabra griega "iodes" que significa "violeta", aludiendo al color de los vapores del yodo.
- Obtención: Courtois estaba experimentando con las cenizas de algas, una buena fuente de sodio y potasio. al tratar las cenizas con un ácido fuerte (ácido sulfúrico) para retirar los compuestos de azufre, Courtois se percató de que salía un vapor de color violeta. Al enfriarlos obtuvo unos cristales oscuros y decidió que era un nuevo elemento, al que llamó yodo.

MÉTODOS DE OBTENCIÓN
- Mediante reacción química del yodato de calcio con dióxido de azufre.
- Por extracción de las cenizas de algas.
- Para obtenerlo ultrapuro se hace reaccionar yoduro potásico con sulfato de cobre.
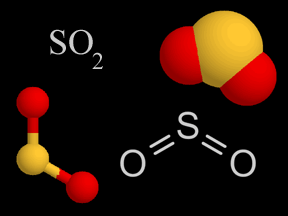 dioxido de azufre
dioxido de azufre
APLICACIONES
- El yodo se emplea como desinfectante de aguas, catalizador en la fabricación de gomas y colorantes.
- El yoduro de plata se emplea en fotografía.
- Se emplea en medicina: ingestión de yoduros y tiroxina (que contiene yodo), el agua de yodo se emplea como desinfectante de heridas.
- Se adiciona, en forma de yoduro, a la sal de mesa, para evitar carencias alimentarias y posibles problemas de bocio.


(yoduro de plata) (sal con yodo)
CARACTERÍSTICAS
- Esta situado en el grupo numero 7 de la tabla periódica
- Es un p que presenta dificultades para disolverse
- En estado natural,sólido, se puede encontrar en yoduros oceánicos
- En actividades humanas, el Yodo esta directamente relacionado con la medicina
- Numero Atómico:53
- Masa atómica: 126,90447u
- Símbolo Atómico: I
- Punto de fusión: 83°C
- Punto de ebullición: 184°C

ASTATO
Astato. Elemento químico con símbolo At y número atómico 85 y hace parte de los metaloides. Es el elemento más pesado del grupo de los halógenos, ocupa el lugar debajo del yodo en el grupo VII de la tabla periódica.

HISTORIA
- Descubridor: Dale Corson, K. MacKenzie, Emilio Segrè.
- Lugar de descubrimiento: USA.
- Año de descubrimiento: 1940.
- Origen del nombre: De la palabra griega "astatos" que significa "inestable", debido a que este elemento carecía de isótopos estables.
- Obtención: Se obtuvo bombardeando el isótopo de bismuto 209Bi con partículas alfa.


Dale Corson Emilio Segrè.
CARACTERÍSTICAS GENERALES/PROPIEDADES PERIÓDICAS Y FÍSICAS
CARACTERÍSTICAS GENERALES
| |
| Nombre: Astato | Símbolo: At |
| Número atómico: 85 | Masa atómica (uma): (209,99) |
| Período: 6 | Grupo: 17 (halógenos) |
| Bloque: p (representativo) | Números de oxidación: -1, +1, +5 |
PROPIEDADES PERIÓDICAS
| |
| Configuración electrónica: [Xe] 4f14 5d10 6s2 6p5 | Radio atómico (Å): - |
| Radio iónico (Å): - | Radio covalente (Å): - |
| Energía de ionización (kJ/mol): 930 | Electronegatividad: 2,20 |
| Afinidad electrónica (kJ/mol): 270 | |
PROPIEDADES FÍSICAS
| |
| Densidad (g/cm3): - | Color: - |
| Punto de fusión (ºC): (302) estimado | Punto de ebullición (ºC): - |
| Volumen atómico (cm3/mol): - | |
HISTORIA DE LA TABLA PERIÓDICA.
CONCLUSIÓN
- Cada historia, característica, uso y obtención de cada elemento nos llevan a comprender la dinámica en que se dan en estas, por ende es importante conocer, indagar e ir más a fondo para con ello lograr grandes cosas como un proceso correcto e identificar a la hora de relacionarse con una tabla periódica, por lo tanto se puede concluir que este trabajo logra despejar algunas dudas e inquietudes sobre los temas que fueron nombrados al comienzo.
WEB-GRAFÍA
GRUPO IV
https://www.lenntech.es/periodica/elementos/c.htm#ixzz5dujfHm1I
https://www.ecured.cu/Carbono
https://prezi.com/pjue9jke03to/copy-of-quimica-grupo-iv-a-de-la-tabla-periodica/
http://www2.udec.cl/quimles/organica/revista/carbono_y_estructuras.htm
http://www.heurema.com/Origenes5.htm
https://www.ptable.com/?lang=es
https://es.slideshare.net/jose2MB/slidos-cristalinos-34832335
https://www.ptable.com/?lang=es
GRUPO V
www.boeing.com.
https://www.ejemplode.com/38-quimica/3128-nitrogeno.html
https://medlineplus.gov/spanish/ency/article/002424.htm
https://www.cancer.gov/espanol/cancer/causas-prevencion/riesgo/sustancias/arsenico
GRUPO VI
https://www.monografias.com/trabajos94/oxigeno-y-su-descubrimiento/oxigeno-y-su-descubrimiento.shtml#quiendesca
https://www.caracteristicas.co/azufre/
https://www.geniolandia.com/13068304/apariencia-y-caracteristicas-del-selenio
http://www.quimicaweb.net/tablaperiodica/paginas/telurio.htm
https://www.euston96.com/telurio/
https://sites.google.com/site/wiki101m5/historia-del-polonio
https://www.monografias.com/trabajos94/oxigeno-y-su-descubrimiento/oxigeno-y-su-descubrimiento.shtml#quiendesca
https://www.caracteristicas.co/azufre/
https://www.geniolandia.com/13068304/apariencia-y-caracteristicas-del-selenio
http://www.quimicaweb.net/tablaperiodica/paginas/telurio.htm
https://www.euston96.com/telurio/
https://sites.google.com/site/wiki101m5/historia-del-polonio
GRUPO VI
http://www.quimicaweb.net/tablaperiodica/paginas/grupoVIIA.htm
https://es.wikipedia.org/wiki/Hal%C3%B3geno
http://www.quimicaweb.net/tablaperiodica/paginas/fluor.htm
https://www.caracteristicass.de/fluor/
http://www.quimicaweb.net/tablaperiodica/paginas/cloro.htm
https://www.caracteristicass.de/cloro/
https://es.wikipedia.org/wiki/Bromo
http://www.quimicaweb.net/tablaperiodica/paginas/bromo.htm
https://es.wikipedia.org/wiki/Yodo
http://www.quimicaweb.net/tablaperiodica/paginas/yodo.htm
https://brainly.lat/tarea/5589277#readmore
https://es.wikipedia.org/wiki/%C3%81stato
http://www.quimicaweb.net/tablaperiodica/paginas/astato.htm
http://www.quimicaweb.net/tablaperiodica/paginas/grupoVIIA.htm
https://es.wikipedia.org/wiki/Hal%C3%B3geno
http://www.quimicaweb.net/tablaperiodica/paginas/fluor.htm
https://www.caracteristicass.de/fluor/
http://www.quimicaweb.net/tablaperiodica/paginas/cloro.htm
https://www.caracteristicass.de/cloro/
https://es.wikipedia.org/wiki/Bromo
http://www.quimicaweb.net/tablaperiodica/paginas/bromo.htm
https://es.wikipedia.org/wiki/Yodo
http://www.quimicaweb.net/tablaperiodica/paginas/yodo.htm
https://brainly.lat/tarea/5589277#readmore
https://es.wikipedia.org/wiki/%C3%81stato
http://www.quimicaweb.net/tablaperiodica/paginas/astato.htm


