INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
PRÁCTICA N°1
"RECONOCIMIENTO DE MATERIALES DE LABORATORIO Y NORMAS DE
SEGURIDAD DE TRABAJO EN EL LABORATORIO"
DOCENTE: DIANA FERNANDA JARAMILLO CARDENAS
ESTUDIANTE: LAURA SOFÍA FLOR TRIANA
Grado: 10-2
Fecha: 15/04/2018
Introducción
A continuación en el presente escrito se dará a conocer las diferentes normas de trabajo e implementos en el laboratorio para consolidar un proyecto educativo referente a el proceso de diferentes funciones donde sea un eficaz cumplimiento.
Estos materiales se clasifican según su estructura, es decir, si son de vidrio, porcelana, madera, metal plástico y goma, por último se mencionará las normas a seguir dentro de un laboratorio, y debemos tener en cuenta que son muy importantes debido a que nos brinda una mejor seguridad.
1. Antes de ingresar a el laboratorio nos dan ciertas normas para acceder a él.
2. Al entrar lo primero que nos ordenan es lavarnos las manos
3. Luego de este procedimiento cada uno se coloca los implementos básicos (bata, guantes, gafas de protección)
4. La profesora asigna a cada estudiante en un puesto para proceder a la actividades dadas
5. Terminada estas labores debemos dejar el laboratorio en perfectas condiciones
































Estos materiales se clasifican según su estructura, es decir, si son de vidrio, porcelana, madera, metal plástico y goma, por último se mencionará las normas a seguir dentro de un laboratorio, y debemos tener en cuenta que son muy importantes debido a que nos brinda una mejor seguridad.
Objetivo
Este trabajo va con el fin de de requerir y facilitar el conocimiento necesario para tener un buen uso de cada implemento y equipos en el laboratorio y así identificar los símbolos de peligro de cada uno de estos. Y por ultimo las normas que se han de seguir
Procedimientos
1. Antes de ingresar a el laboratorio nos dan ciertas normas para acceder a él.
2. Al entrar lo primero que nos ordenan es lavarnos las manos
3. Luego de este procedimiento cada uno se coloca los implementos básicos (bata, guantes, gafas de protección)
4. La profesora asigna a cada estudiante en un puesto para proceder a la actividades dadas
5. Terminada estas labores debemos dejar el laboratorio en perfectas condiciones
Marco Teórico
Materiales De Vidrio
Embudo: Material de laboratorio para transvasar líquidos a recipientes de boca cerrada, pueden ser de vidrio o de plástico
Tipos De Embudo
1. Embudos planos: de diseño normal para operaciones básicas. Existen en varias dimensiones, con el cuello más largo o más corto.

2. Embudo de filtración: de forma cónica y generalmente fabricados en vidrio. Los modelos para filtrado en frío poseen un tubo de salida, pero los modelos para filtración en caliente están hechos de vidrio pyrex y no poseen tubo de salida.
3. Embudo Büchner: está fabricado en porcelana e incluyen una placa de vidrio sinterizado o una base de porcelana perforada. Estos se utilizan en la filtración a baja presión con un matraz de Büchner o kitasato, conectados a una bomba de vacío.

- Vaso Precipitado: Recipiente cilíndrico de vidirio fino, utilizado en el laboratorio para preparar y calentar sustancias y transpasar líquidos.
- Frasco de reactivo: permite guardar sustancias para almacenarlas. Alteradas por la acción de la luz del sol, los de color transparente se utilizan para guardar sustancias que no son afectadas por la luz solar
- Condensador Liebig: Es de forma lineada que se usa como un refrigerante de agua.
- Condensador Graham: Es un condensador en forma de espiral que es usado refrigetante
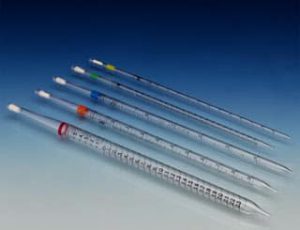
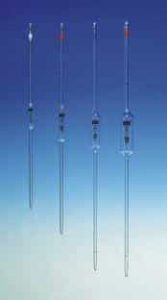
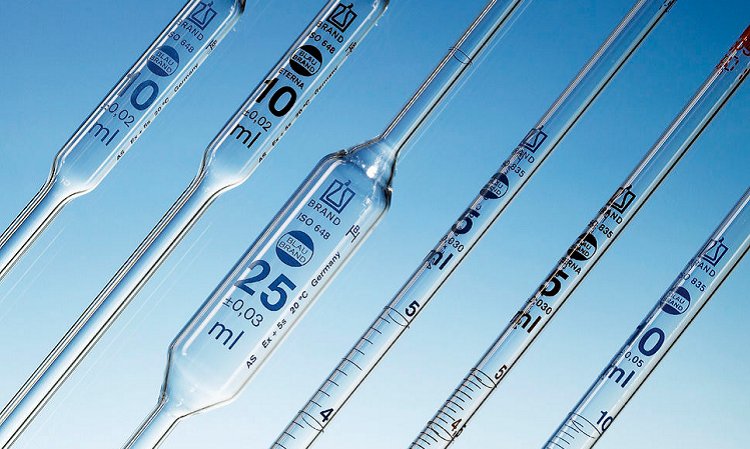
- Pipeta: Es un instrumento volumétrico que permite medir la alícuota de líquido con bastante precisión. Es decir, estas pipetas permiten la transferencia de un volumen generalmente no mayor a 20 ml de un recipiente a otro de forma exacta. este permite medir alícuotas de líquido con bastante precisión. Suelen ser de vidrio. Está formado por un tubo transparente que termina en una de sus puntas de forma cónica, y tiene una graduación (una serie de marcas grabadas) indicando distintos volúmenes.
Tipos De Pipeta
1. Pipeta Graduadas: Están calibradas en unidades convenientes para permitir la transferencia de cualquier volumen desde 0.1 a 25 ml. Hacen posible la entrega de volúmenes fraccionados.

2. Pipeta Volumétrica: La Pipeta volumétrica esta hecha para entregar un volumen bien determinado, el que esta dado por una o dos marcas en la pipeta. Si la marca es una sola, el líquido se debe dejar escurrir sin soplar, que baje por capilaridad solamente esperando 15 segundos luego que cayo la última gota.

- Erlenmeyer: Frasco contenedor utilizado para hacer reacciones y montajes.
- Micropipeta: Utensillo de laboratorio utilizado para succionar y transferir pequeños vulúmenes

- Balón fondo plano: Frasco utilizado principalmente en montajes de destilación.

- Pera de dencantación: Se emplea para separar líquidos inmiscibles, para la separación de fases líquidas de distinta densidad.

- Tubo centrífuga: Frasco de plástico para utilizar en sepratación de sustancias.
- Termometro: Instrumento par medir la temperatura

- Frasco lavador: Frasco contenedor de agua destilada
- Balón Volumétrico: Frasco contenedor, utilizado para realizar soluciones de concentración conocida.

- Pipeta Volumétrica: Material de laboratorio para medir y tranpasar volúmenes de líquidos.

- Jeringa: Enbolo insertado en un tubo utilizado paa tranferis sustancias con la ayuda de una aguja.
- Balón de pico: Recipiente de vidrio esférica y cuello largo, balón con un tubo lateral de desprendimiento. Dentro de el se coloca el sistema que desea fraccionar en fase líquida.
- Portaobjetos: Fina capa de cristal sobre el cual se disponen objetos para su examen microscópicos.
- Metraz: Recipiente de cristal donde se mezclan las soluciones químicas, generalmente de forma esférica y con un cuello recto y estrecho, que se usa para contener líquidos; se usa en los laboratorios.
- Tubo de ensayo: Tubo cilíndrico pequeño utilizado en la contención de muestras líquidas y también para calentarla.

- Gotero: Tubo con una perilla de goma para contar las gotas de los líquidos

- Picnómetro: Recipiente que se utiliza para le medición de la densidad de un líquido
- Vidrio reloj: material de laboratorio utilizado para pesar sustancias y tapar recipientes.
- Breaker: Frasco contenedor, utilizado para mezclas.
Materiales De Porcelana
- Luna de reloj: Es un instrumento de laboratorio de química que se usa para pesar sustancias solidas o desecar pequeñas cantidades en disolución.

- Crisoles: El crisol de porcelana es un material de laboratorio utilizado principalmente para calentar, fundir, quemar, y calcinar sustancias.
- Crisol con pico: se usan en el laboratorio de química para hacer experimentos o reacciones que requieren de mucha temperatura, ya que los crisoles se pueden utilizar hasta en temperaturas de 1000°C.
- Mortero con pilón: Se usa para moler o reducir el tamaño de las sustancias.

Materiales Metálicos
- Mechero de alcohol o ron: Sirve para calentar sustancias con alcohol o ron.

- Rejilla de asbesto: Encargada de repartir la temperatura de manera uniforme, cuando se calienta con un mechero. Para esto se usa un trípode de laboratorio, ya que actúa como un sostenedor a la hora de experimentar.

- Cucharilla de combustión: Se utilizan para realizar diferentes combustiones de sustancias, para observar el tipo de flama, reacción, etc.

- Pinza: forma parte del equipamiento de laboratorio, mediante la cual se pueden sustentar diferentes objetos de vidrio (embudos de laboratorio, buretas...) o realizar montajes más elaborados (aparato de destilación). Se sujetan mediante una doble nuez a un pie o soporte de laboratorio o, en caso de montajes más complejos (línea de Schlenk), a una armadura o rejilla fija.
- Gradilla: Es utilizada para sostener y almacenar gran cantidad de tubos de ensayo, de todos los diámetros y formas.
- Escobillas de cerda: Según el diámetro se utilizan luego de los experimentos de física, química o pruebas de laboratorio para lavar: tubos de ensayo, buretas, vasos de precipitado, erlenmeyer, etc.
- Tripode: Se utiliza cuando no se tiene el soporte universal para sostener objetos con firmeza. Es ampliamente utilizado en varios experimentos. La finalidad que cumple en el laboratorio es solo una, ya que su principal uso es como herramienta de sostén a fin de evitar el movimiento. Sobre la plataforma del trípode se coloca una malla metálica para que la llama no dé directamente sobre el vidrio y se difunda mejor el calor.
Normas de seguridad de trabajo en el laboratorio
- No trabajar solo en el laboratorio
- Experiencias no autorizadas
- No consumir bebidas mientras se encuentre dentro del laboratorio
- Siempre utilizar los implementos de protección, como gafas, guantes, batas, etc.
- Lea todas las intrucciones de los reactivos antes de que sean usados
- Cuando trabaje con fuego tenga la precaución de recogerse el cabello
- No fume
- No apunte los tubos de ensayo frente a ningun compañero
- Trabaje lejos de los fuentes de agua cuando trabaje con reactivos que reaccionan violentamente frente a ella, por ejemplo con los metales alcalinos
- Prepare siempre un mapa de proceso para estar seguro de lo que está haciendo.
- Cuando termine de trabajar asegúrese que las fuentes de gas, luz y agua queden cerradas
- Cuando mexcle ácidos concentrados y agua, vierta el ácido sobre el agua.

ENCUESTA
1.
2.
3.
4.
CONCLUSIÓN
- Los resultados de este trabajo nos permite conocer las reglas que se deben aplicar en un laboratorio para evitar cuelquier peligro y tener la máxma seguridad con los implementos necesarios para el ingreso de estas aulas.
- Es vital seguir y leer instrucciones debido a que las normas de seguridad que se presetan en los laboratorios funcionan para nuestro bienestar al estar dentro.
WEBGRAFÍA
http://www.monografias.com/trabajos93/materiales-e-instrumentos-laboratorio/materiales-e-instrumentos-laboratorio.shtml
https://www.tplaboratorioquimico.com/laboratorio-quimico/materiales-e-instrumentos-de-un-laboratorio-quimico/pipeta.html
https://mx.answers.yahoo.com/question/index;_ylt=AwrJzBkIYtNazXsAglzXdAx.;_ylu=X3oDMTByOHZyb21tBGNvbG8DYmYxBHBvcwMxBHZ0aWQDBHNlYwNzcg--?qid=20090915100841AARZnhr&p=frasco%20de%20reactivo